导语
南开大学汪清民教授课题组发展了利用光镍协同催化烷基硼酸与芳基卤化物之间的脱硼交叉偶联反应,该方法展现出良好的官能团耐受性,且温和的反应条件能够实现药物分子的官能团化。此外,该方法可扩展至烯烃的三组分酰化/芳基化反应,以高对映体过量获得产物。而且,这些反应可在连续流条件下进行,提高了该方法的可扩展性、安全性及整体效率。相关研究成果发表于Chinese Chemical Letters(DOI: 10.1016/j.cclet.2025.111053)。
前沿科研成果
过去十年间,光氧化还原催化在有机合成领域被广泛应用,过渡金属/光氧化还原双催化的发展,让许多新型交叉偶联反应成为现实。金属光催化利用二者协同效应,对有机化学影响深远(图 1A 左)。光催化剂能产自由基、调控金属催化剂氧化态,拓宽了交叉偶联反应试剂的选择范围。早期,光催化剂用于含氧化还原剂底物的单电子转移,生成开壳中间体,自由基再与过渡金属催化剂作用,形成 C(sp3)-C(sp2)键。MacMillan 等团队利用其氢原子转移策略,将自由基前体范围拓展至简单烷烃,金属光氧化还原催化剂也用于卤代物的卤原子转移反应。近年来,化学家聚焦金属/光氧化还原双催化实现烯烃双官能团化,开发了多种烯烃分子间碳芳基化方法(图 1A 右)。尽管该领域成果丰硕,但对自由基前体及其活化方法的需求,仍是研究动力。
过渡金属催化交叉偶联反应,推动了药物和农用化学品合成。但引入C(sp3)杂化片段仍是难题。硼中心的Suzuki–Miyaura(SMC)交叉偶联反应可有效构建C(sp2)-C(sp2)键,具备官能团耐受性好、硼副产物毒性低等优势(图 1B)。不过,将其用于C(sp3)键时仍面临诸多挑战,如氧化加成和过渡金属化速率低、烷基金属中间体易发生 β-氢消除,并且该反应需使用对空气和水分敏感的有机金属化合物、高温及长时间反应,限制了实际应用。因此,开发温和、选择性的硼-烷基SMC反应意义重大。
Molander和Akita 团队率先利用光氧化还原催化,在温和条件下将三氟硼酸盐转化为烷基自由基,开拓了烷基硼化合物新应用,推动了硼酸酯等硼试剂的开发。近年来,光介导硼-烷基SMC反应研究成果频出,但硼中心前体局限于三氟硼酸钾和硼酸酯。市售简单烷基硼酸因氧化电位高、酸性弱,很少用作烷基前体,阻碍了其在自由基交叉偶联反应中的应用。化学家虽开发了降低其氧化电位的方法,但多数仅适用于迈克尔加成 等简单反应,在过渡金属催化反应中难以应用,限制了其在药物分子修饰中的作用。
为了使烷基硼酸能够参与可见光促进的Suzuki–Miyaura交叉偶联(SMC)反应的光催化循环,必须降低这些化合物的氧化电位。然而,现有的大多数实现此目的的方法都使用诸如水或路易斯碱(4-二甲氨基吡啶 )之类的添加剂,但大多数光催化/镍催化反应对水非常敏感,并且路易斯碱可能会影响配体与镍之间的配位。作者设想,或许可以使用通常用于金属/光催化的试剂(如无机碱)来降低烷基硼酸的氧化电位;通过这种方式,能够实现金属/光氧化还原双催化的自由基SMC反应(图 1C)。
事实上,作者在此报告一种通过光氧化还原/镍双催化实现游离烷基硼酸与芳基溴之间脱硼自由基交叉偶联反应的方法。作者使用磷酸钾(K3PO4)来降低烷基硼酸的氧化电位,使其能够参与光催化循环,且无需任何额外的反应组分。作者的方法展现出良好的官能团耐受性,温和的反应条件允许对药物分子进行官能团化。此外,该方法可用于烯烃的三组分碳酰化/碳芳基化反应。具体而言,作者通过使用手性双咪唑啉配体实现了烯烃的对映选择性三组分碳芳基化。另外,作者采用一锅两步法对1-(4 -溴苯基) 乙醇的两个反应位点进行修饰,直接合成了布洛芬。

图1. 从灵感启发到反应设计(来源:Chinese Chemical Letters)
作者接着评估了反应的适用范围。如图2所示,1a与带有不同长度直链烷基的硼酸反应,能高效生成相应产物(3b-3f)。支链烷基硼酸和苄基硼酸也与该催化体系兼容,分别与1a反应生成3g和3h。接下来,作者考察了一系列仲烷基硼酸作为与芳基卤化物反应的偶联底物。开环仲硼酸成功实现偶联,生成3i 和3j。此外,具有五元、六元或七元环的环状硼酸以80%-85% 的产率生成相应的偶联产物3k-3m。带有四氢吡喃环(3n)或茚满环(3p)的化合物也是可行的底物。然后,作者探索了各种芳基溴偶联伙伴 1 的反应。一般来说,带有吸电子官能团的芳基溴表现最佳,能以中等至良好的产率生成相应产物。对位取代的溴苯,带有酯基(3p)、酮基(3q)、砜基(3r)、醛基(3s)、环状酮基(3t、3u)、磺酰胺基(3v、3w)或硅炔基(3x)都具有良好的耐受性。有趣的是,作者的方法与韦克斯(Weix)的芳基溴 / 醛还原偶联方法互补,后者无法耐受无位阻的醛。
此外,间位取代的溴苯以 75% 的产率生成 3y,溴苯本身也与该反应兼容,3z 和 3aa 的产率适中。令人欣慰的是,带有供电子基团(如苯基、甲氧基或三氟甲氧基)的芳基溴也是可行的底物,以 54%-81%的产率生成所需产物3ab-3ae。该反应展现出出色的官能团耐受性和选择性,作者发现带有游离羟基的底物生成了所需产物(3af 和 3ag),且未检测到C-O偶联副产物。考虑到含氮杂环在生物活性分子制备中的重要性,作者很高兴地发现杂芳基溴也适用于该交叉偶联反应,以 65%-81% 的产率生成预期产物3ah-3aj。
由于季碳中心的构建在包括天然产物在内的结构复杂化合物的合成中是一个常见挑战,作者进而探究作者的活化方法是否可用于生成具有季碳中心的分子。使用上述最佳条件,作者无法获得高产率的目标产物 3ak,但当作者针对该底物重新优化反应条件后,以 80% 的产率得到了 3ak。在重新优化的条件下,叔丁基硼酸与带有酯基(3al)、酰胺基(3am、3an)、醛基(3ao)或醚基(3ap)的对位取代溴苯的反应具有良好的耐受性。
为了进一步探究该Suzuki–Miyaura交叉偶联(SMC)反应的官能团耐受性,作者对一系列源自药物分子、农药分子和天然产物的溴苯 4 进行了反应(图 3)。这些反应以 40%-81%的产率生成了相应的 C(sp3)-B芳基化产物(5a-5aa)。作者的研究结果证实,作者的SMC反应具有出色的官能团耐受性,并且与卤素原子、酰胺、苯胺和其他杂芳环、酯、醚、烯烃和酮等官能团兼容。

图2. 底物拓展(来源:Chinese Chemical Letters)

图3. 药物分子的衍生(来源:Chinese Chemical Letters)
作者发现,将光催化剂与带有手性联咪唑啉配体的镍催化剂相结合,能够使烯烃 6 与游离硼酸 2 和芳基溴化物 1 发生不对称双碳官能化反应,从而得到对映体富集的 α-芳基羰基化合物 7(图 4A)。为了进一步说明作者这一方法的合成潜力,作者用苯甲酰氯替代了芳基溴化物,并进行了克级规模的连续流B-烷基化单电子转移催化(SMC)反应,以合成环己基 (苯基) 甲酮(8,图 4B)。通过使用 1.5 毫升/分钟的流速和 10 小时的停留时间,作者能够将该反应扩大规模至 8 毫摩尔。随后,作者通过进行一系列的转化反应来生成产物 9-16,以此探索了酮类化合物8的合成潜力。由于两个反应位点的连续转化最近受到了化学家们的广泛关注,作者还进行了 1-(4 - 溴苯基) 乙醇(17)的反应,并实现了其两个反应位点的连续转化,从而得到了布洛芬(18)。
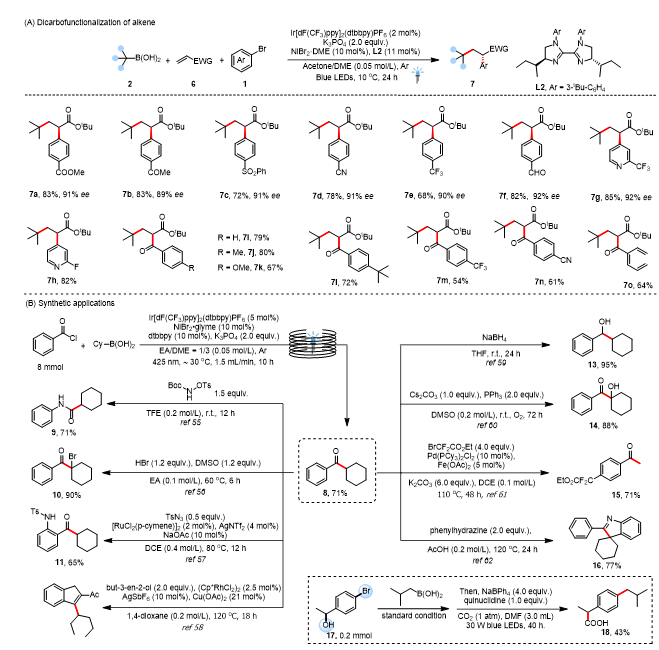
图4. 合成应用(来源:Chinese Chemical Letters)
总结: 在该研究中,作者开发了一种通过光氧化还原/镍双催化实现烷基硼酸脱硼交叉偶联反应的方法。作者通过生成烷基硼酸- K3PO4络合物降低了烷基硼酸的氧化电位,这避免了对额外反应组分、高温反应条件以及昂贵催化剂的需求,而这些因素限制了先前报道方法的实用性。该新方法使作者能够合成具有季碳中心的化合物,并且当引入手性配体时,能够合成手性 α- 芳基羰基化合物。该方法展现出强大的官能团耐受性,而且烷基硼酸底物的合成简便,这使得作者的方法非常适合在药物化学和全合成应用中,对与生物相关的烷基底物进行官能团化。
该篇工作通讯作者为汪清民教授,南开大学博士研究生岳福阳为该论文的第一作者。上述研究工作得到了国家重点研发计划和国家自然科学基金以及南开大学有机新物质创造前沿科学中心的资助。特别感谢天津凯米斯科技有限公司提供优秀奖学金。
汪清民课题组简介

南开大学汪清民课题组隶属于南开大学元素有机化学全国重点实验室、有机新物质创造前沿科学中心和化学学院。目前课题组拥有老师和研究生30多人。研究方向为生态农药和药物及功能助剂创制和环境友好的绿色合成反应。承担科技部、农业农村部、国家自然科学基金委、教育部、天津市等各种科研项目四十多项。先后在Sci. Adv.、Nat. Commun.、Angew. Chem. Int. Ed.、Adv. Sci.、ACS Cent. Sci.、Chem. Eng. J.、ACS Catal.、Chem. Sci.、Green Chem.、ChemSusChem.、ACS Sustainable Chem. Eng.、Green Synth. Catal.、Arthritis & Rheumatism 、J. Agric. Food Chem.、Pest Manag. Sci.、J. Med. Chem等杂志上发表论文300余篇;授权了100多项中国和美国及欧洲等发明专利。出版著作7部 (章);发明了仿生农药拟除虫菊酯系列产品和重多农药品种及高端精细化学品的清洁生产新方法,已成功应用于工业化大生产,产生了巨大的经济效益;创制了多个超高效的植物病毒病防治药剂和绿色杀虫杀螨剂候选品种以及国家Ⅰ类新药,处于产业化开发的不同阶段。培养毕业了100多名访问学者、博士后、博士生、硕士生。