环丙烷作为一种重要的结构单元,广泛存在于天然产物、药物等生物活性分子中,展示了独特的化学特性。然而,由于其固有的高环张力,环丙烷易于发生开环反应,这使得其合成面临显著挑战。通过化学家们的不懈努力,已开发出多种合成策略,如Simmons−Smith反应、Kulinkovich反应、Corey−Chaykovsky反应以及过渡金属催化的烯烃环丙烷化反应(通常使用重氮化合物)(图1A)。这些方法虽然在环丙烷合成中展现了各自的优势,但仍存在诸多局限性,例如需使用高活性或危险试剂、底物适用范围有限以及产物多样性受限等。
近年来,活泼亚甲基化合物因其具有的操作简便、价格低廉且易于获取的特性,在合成化学领域得到了广泛应用。通过活泼亚甲基化合物与烯烃的反应来合成环丙烷衍生物是一条直接且颇具吸引力的途径。然而,从未活化烯烃和亚甲基化合物直接合成环丙烷衍生物的方法仍未被充分开发。因此,开发一种在温和条件下从易得原料出发、能够兼容多种官能团的环丙烷化反应方法,仍然是一个极具挑战性的课题。在过去的几十年中,有机电化学合成已逐渐发展成为一种有机合成化学的强大工具。近期,徐海超课题组通过电化学途径成功实现了分子内的环丙烷化反应(J. Am. Chem. Soc. 2022, 144, 2343,图1B)。然而,开发一种未活化烯烃和活泼亚甲基化合物分子间电化学环丙烷化的方法,仍然是亟待解决且极具挑战性的。
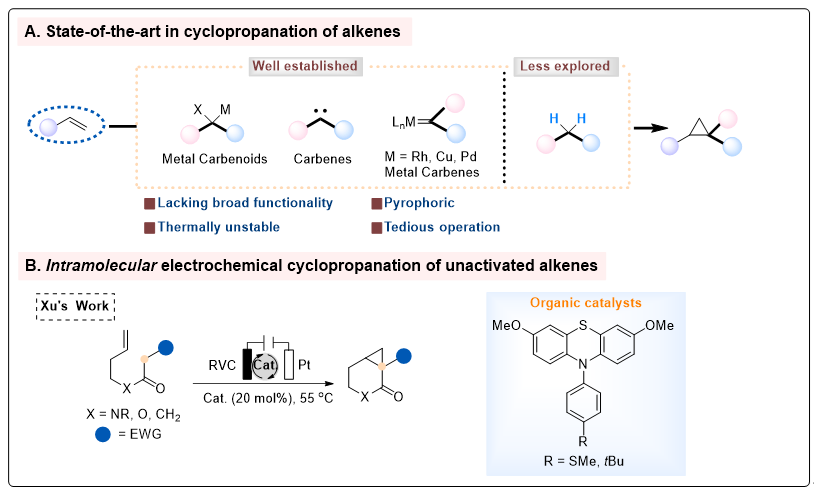
图1. 合成环丙烷的策略
南开大学仇友爱课题组聚焦于有机电合成化学及资源小分子高效转化(Acc. Chem. Res. 2025, 58, 113-129; Nat. Catal. 2024, 7, 412-421; Angew. Chem. Int. Ed. 2022, 61, e202207746; Angew. Chem. Int. Ed. 2022, 61, e202210201; Angew. Chem. Int. Ed. 2023, 62, e202214710; Nat. Commun. 2022, 13, 3774; Angew. Chem. Int. Ed. 2022, 62, e202312803; Nat. Commun. 2024, 15, 2780; Nat. Commun. 2024, 15, 3832; Angew. Chem. Int. Ed. 2023, 62, e202306679; Angew. Chem. Int. Ed. 2023, 62, e202311941; Nat. Commun. 2023, 14, 6467; Angew. Chem. Int. Ed. 2022, 61, e202115178; Nat. Commun. 2024, 15, 5181; CCS Chem. 2024, in press)。近日,仇友爱课题组报道了电化学条件下未活化烯烃与活泼亚甲基化合物的环丙烷化反应(图2)。该工作具有以下特点:a) 实现电化学条件下未活化烯烃和活性亚甲基化合物的直接环丙烷化反应;b) 广泛的底物范围,并可用于生物活性分子的后期修饰;c) 高效的电化学策略,以廉价、易得的Cp2Fe作为介质,由亚甲基试剂生成α-羰基自由基;d) 避免了贵金属催化剂和化学计量氧化剂的使用;e) 成功实现了生物活性分子的直接环丙烷化,表现出优异的选择性。
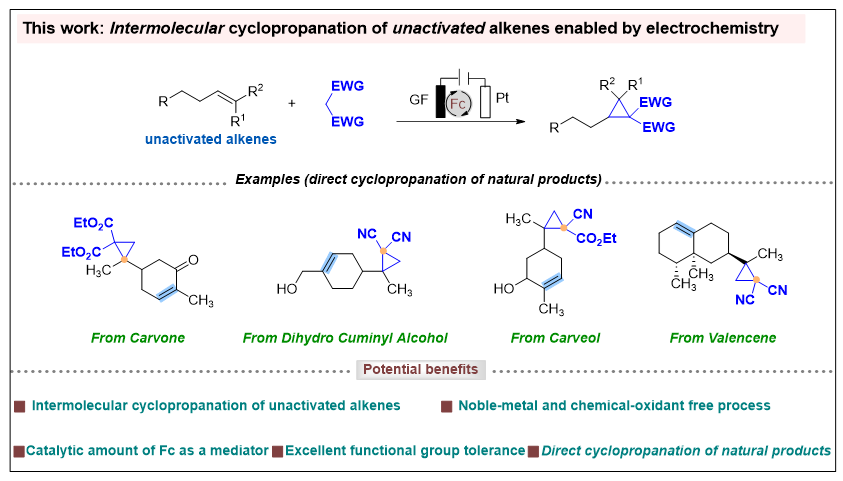
图2. 电化学未活化烯烃与亚甲基化合物的环丙烷化反应
该方法的底物普适性良好,能够兼容含有不同取代基、不同碳链长度、不同官能团(如-Br、-OTs、-OH等)的未活化烯烃,其中包括末端烯烃、支链α-烯烃、线性烯烃、内烯烃等,都能顺利参与反应,生成相应的环丙烷产物(图3A)。此外,对活性亚甲基化合物的适应性强。各类腈酯,β-酮酯、β-膦酸酯、β-酰胺酯等活性亚甲基化合物都可以顺利得到环丙烷化的产物,并且当乙基-2-氰基乙酸酯作为反应物时,能够以较高的区域选择实现未活化烯烃的环丙烷化(49、56,图3B)。
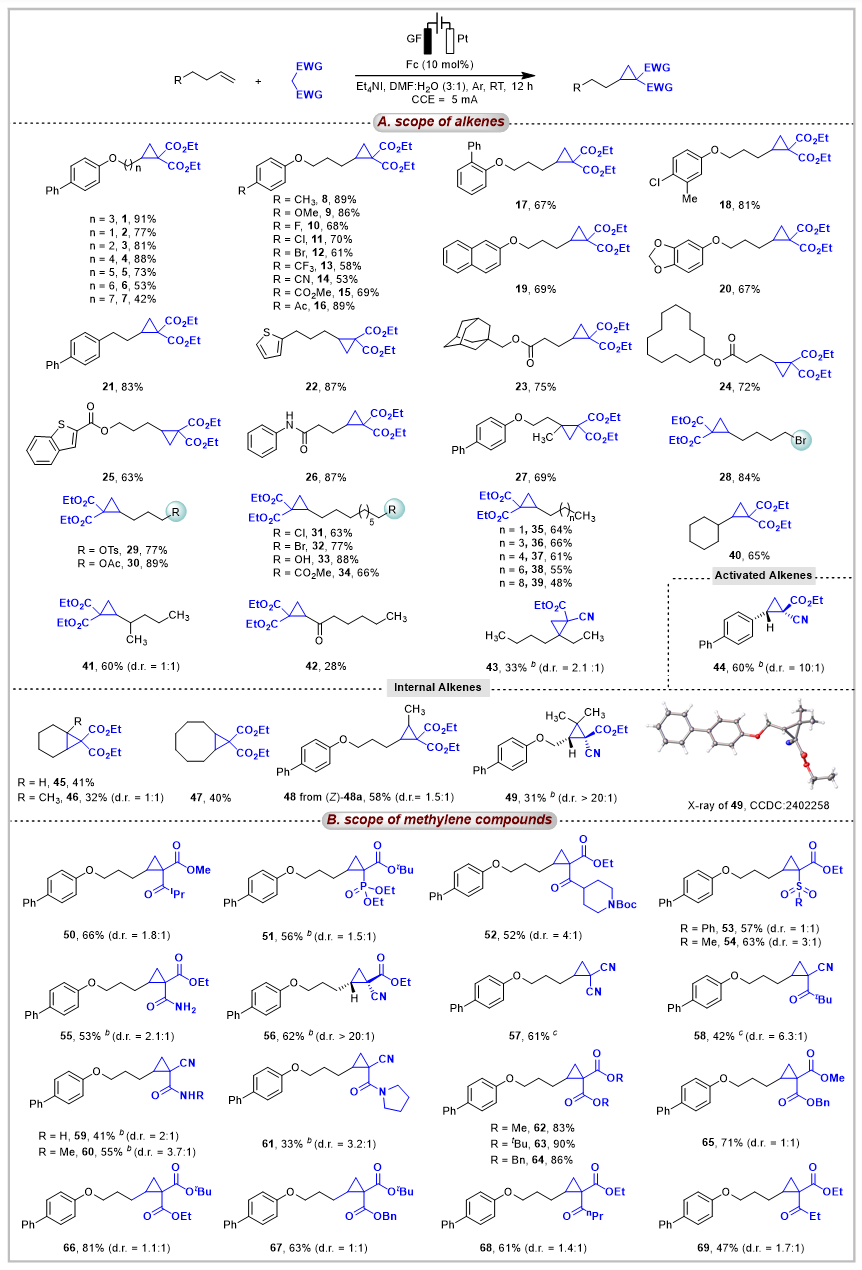
图3. 底物普适性研究
另外,该策略能够实现复杂天然产物、药物衍生物的后期环丙烷化修饰(图4)。以含有烯烃结构的药物(如薄荷醇、萘普生等)、天然化合物(如雌二醇、青蒿琥酯等)和碳水化合物(如果糖、半乳糖等)为底物,均可在温和条件下进行环丙烷化反应,为药物研发和天然产物结构修饰提供了有效的手段。值得一提的是,该电化学环丙烷化过程具有出色的区域选择性。当分子中存在两种类型的碳-碳双键时,反应优先在末端烯烃上发生;在特定情况下,如形成更稳定的三级碳自由基中间体时,反应也能选择性地在内部烯烃位置进行。此外,该反应还可以实现克级规模的制备(图5A)。
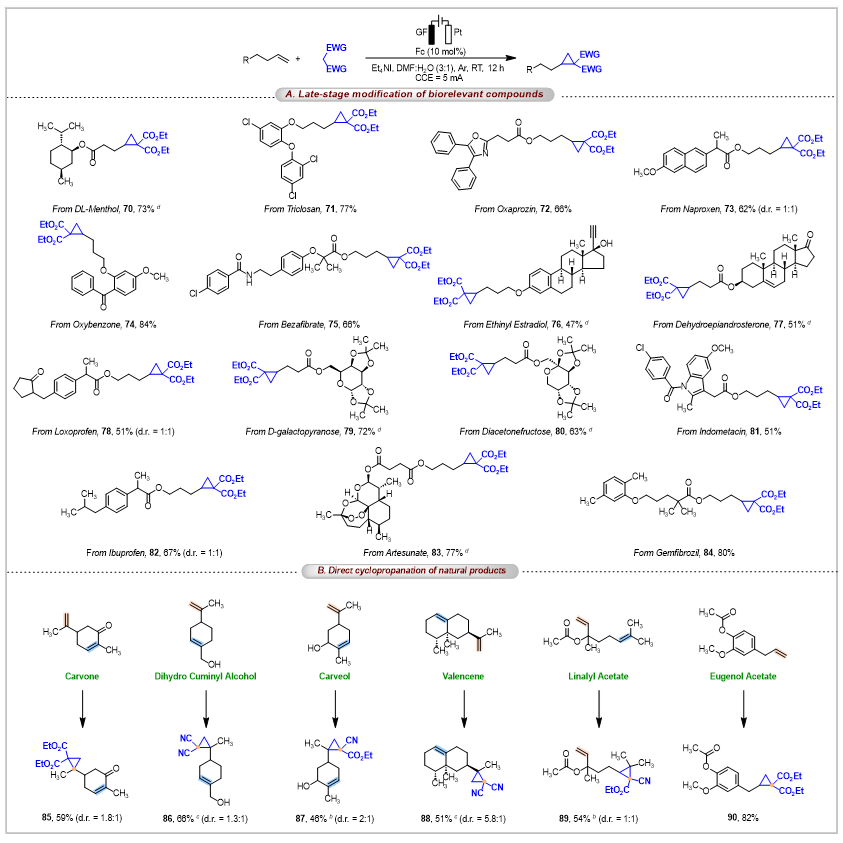
图4. 后修饰的天然产物和氨基喹啉控制的支链产物的普适性探索
作者对机理展开了细致的研究。首先,一系列的自由基捕获实验和EPR实验充分证明了该反应经历的自由基过程(图5B、图5C)。然后,中间体捕获实验表明β-碘取代化合物(97)是该转化过程中的关键中间体(图5D)。作者接下来进行了一系列的CV测试(图5E),证明了Fc作为媒介将活性亚甲基试剂转化为碳自由基。此外,作者还进行了环丙烷化合物的衍生化实验,得到了一系列衍生化的产物(图5G)。
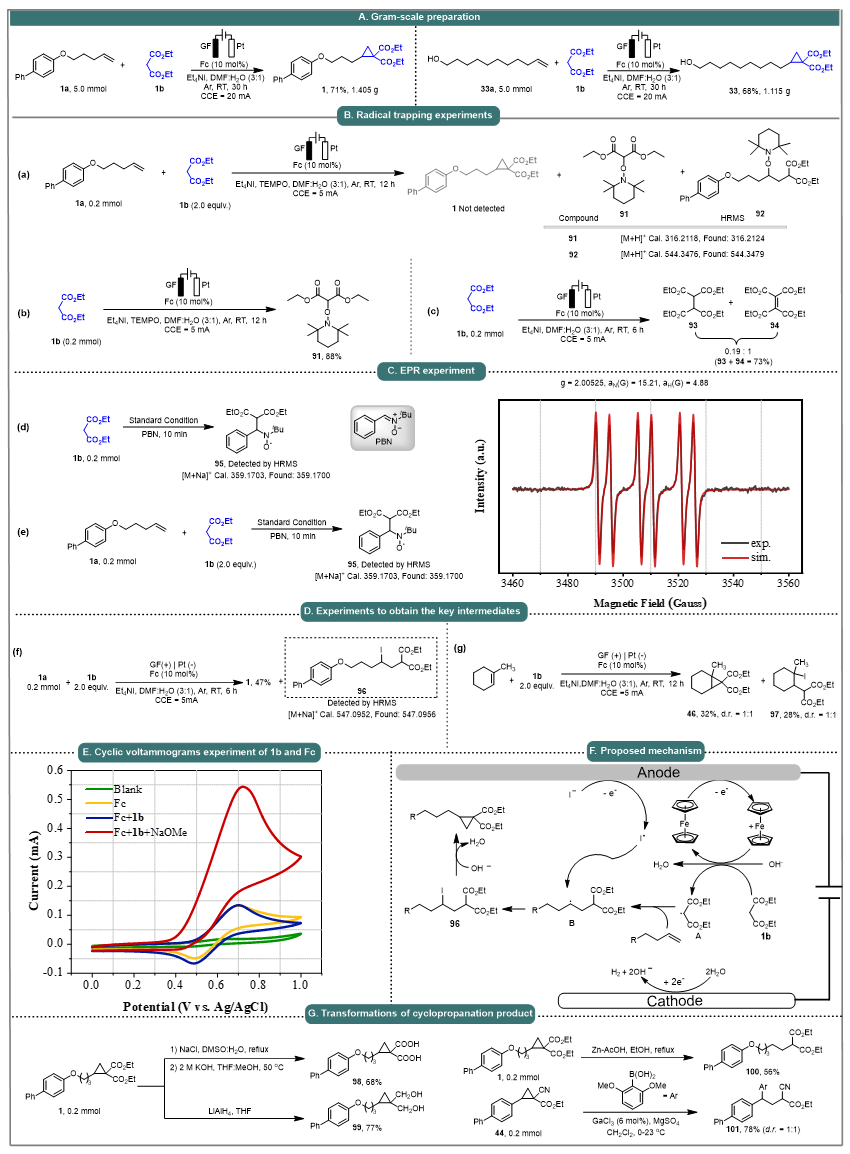
图5. 机理研究
根据机理研究,作者提出了可能的机理循环(图5F)。首先,Cp2Fe在阳极上被氧化生成 Cp2Fe+。然后,亚甲基底物1b在Cp2Fe+的作用下生成α-羰基自由基A。然后,自由基A与未活化的烯烃通过分子内加成反应发生反应生成亲核烷基自由基加合物B。随后,烷基自由基B被I•捕获从而生成中间体96。最后,96发生分子内亲核取代反应生成最终的环丙烷化产物。
小结
仇友爱团队发展了在电化学条件下非活化烯烃和活泼亚甲基化合物的环丙烷化反应。该方法在温和条件下进行,底物范围广泛。该方法为天然产物后期功能化中环丙烷单元的安装以及天然产物的直接环丙烷化提供了一条便捷且高效的途径。该工作得到了科技部重点研发专项、国家自然科学基金委、中央高校基本科研业务费及南开大学有机新物质创造前沿科学中心专项资金的支持。相关成果发表在Angewandte Chemie International Edition 上,并被选为Hot Paper。南开大学化学学院仇友爱研究员为通讯作者,博士生刘敏为文章的第一作者。
原文(扫描或长按二维码,识别后直达原文页面):

Electrochemical Cyclopropanation of Unactivated Alkenes with Methylene Compounds
Min Liu, Yanwei Wang, Chao Gao, Jingpei Jia, Zile Zhu, Youai Qiu*
Angew. Chem. Int. Ed. 2025, 64, e202425634, DOI: 10.1002/anie.202425634
作者简介
仇友爱,南开大学化学学院特聘研究员、博士生导师、独立课题组组长(PI),南开大学“百名青年学科带头人”,入选国家高层次人才青年项目。2015年6月博士毕业于浙江大学化学系,师从麻生明教授。2015年9月加入瑞典斯德哥尔摩大学Jan-Erling Bäckvall教授课题组从事博士后研究。2017年9月加入德国哥廷根大学Lutz Ackermann教授课题组从事博士后研究。2019年11月起,获日本学术振兴会特别研究员奖学金(JSPS Fellowship),作为访问研究员加入日本理化学研究所(RIKEN)侯召民主任研究员课题组。2020年9月底入职南开大学化学学院元素有机化学国家重点实验室,开始独立研究工作,主要开展绿色有机合成研究,特别是有机电合成的研究,对惰性分子的电催化转化开展了系统的研究。长期从事有机电化学、自由基化学及资源小分子电化学高效转化等。以通讯作者及第一作者发表学术论文50余篇。
仇友爱课题组网站:
https://www.x-mol.com/groups/qiu_youai

仇友爱课题组热诚欢迎师资博士后、博士和硕士研究生加盟,有意者请和仇老师联系:qiuyouai@nankai.edu.cn