导读
硅环的合成在有机合成、药物化学以及材料化学领域具有重要的应用,由于缺乏通用的合成方法,从而导致合成含硅的四氢化萘以及苯并环庚硅烷的研究相对较少。近日,南开大学赵东兵课题组在Angew发表论文,基于Pd-催化硅的交叉偶联反应,实现了一种高效且通用的扩环方法,可以制备多种含硅的四氢化萘以及苯并环庚硅烷衍生物。文章链接DOI:10.1002/anie.202001539.
(图片来源:Angew. Chem. Int. Ed.)
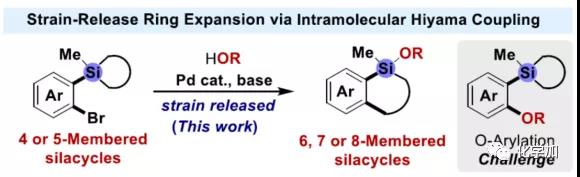
“碳/硅转换”是新材料、药物和农药开发中一种创新的策略,而含硅的四氢化萘和苯并环庚硅烷结构单元,在许多市售药物和天然产物种普遍存在(Figure 1a)。鉴于此,对含硅的四氢化萘和苯并环庚硅烷的合成研究具有重要意义。然而,迄今为止,由于缺乏通用的合成方法,从而导致含硅的四氢化萘和苯并环庚硅烷的开发严重不足(Figure 1a)。而合成此类骨架的典型方法存在以下弊端,如通用性低、反应条件苟刻、需要多步反应等。因此,迫切需要开发一种通用且高效的策略合成此类骨架。
(图片来源:Angew. Chem. Int. Ed.)
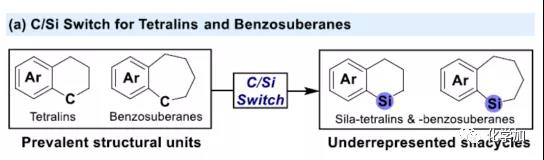
在过去的几十年中,钯催化的Hiyama-Denmark交叉偶联反应已成为一种高效构建碳-碳新键的策略(Figure 1b)。一般来说,-SiR3基团作为交叉偶联反应中的离去基团,并转化为相应的硅副产物。作者设想,是否可将Hiyama-Denmark交叉偶联反应于分子内的扩环反应,从而快速构建各种硅环骨架。实验结果表明,由于五元硅酸酯固有的环张力以及释放路易斯酸的性质,从而增强了四、五元硅环被亲核试剂活化为五配位硅酸盐的倾向(Figure 1c)。因此,基于有机硅的偶联反应,四、五元硅环似乎更容易发生转金属化,从而可通过在邻位引入芳基溴化物进一步增强反应的活性,实现分子内的Hiyama-Denmark交叉偶联,获得扩环产物。此外,由于反应过程中存在芳基卤化物与O或N-亲核试剂的交叉偶联,因此需选择合适的亲核试剂和催化体系来抑制该过程,从而实现扩环。在本文中,作者主要介绍了在Pd-催化下,基于硅的交叉偶联反应,实现四和五元硅环的扩环(Figure 1d)。
(图片来源:Angew. Chem. Int. Ed.)
环丁硅烷(SCB)由于具有高张力和Lewis酸性,已被广泛用作过渡金属催化反应中硅的合成子。因此,作者以环丁硅烷衍生物1a作为模型底物,进行了相关Pd-催化条件的筛选。通过大量的条件筛选,当在5 mol%的Pd(PtBu3)2,TMSNEt2(1.5当量)和tBuOH作为溶剂和亲核试剂时,在80 ℃下反应24 h,即可获得87%产率的目标产物2a。
紧接着,作者对底物环丁硅烷1和亲核试剂的范围进行了研究(Figure 2)。当苯环的3-6位带有电中性、富电子或吸电子基团时,在上述标准条件下反应,均可获得良好至极好收率的2b-2i。含有3,6-、4,5-、5,6-、4,6-和5,6-二取代的底物也能够顺利进行反应,获得相应的产物2j-2q。同时,在邻位含有杂环基团时,也可获得相应的杂环产物2r。此外,作者也对亲核试剂进行了相关的研究。当将tBuOH改为不同的醇和酚作为亲核试剂和溶剂时,均可获得相应的产物2s-2w。同时将溴和杂环丁硅烷基团分别引入萘的1位和8位,依旧可以顺利反应,从而获得七元硅环产物2x-2y。

(图片来源:Angew. Chem. Int. Ed.)
为了获得七元环苯并环庚硅烷产物,作者将环丁硅烷1a改为环戊硅烷3a,在上述标准条件下反应,仅获得痕量的目标产物4a。因此,作者又对反应条件进行了广泛的筛选,当使用DMF/CyOH(1:1)的混合溶剂(CyOH作为亲核试剂)时,在150 ℃下反应24 h,即可获得高达91%收率的产物4a。
随后,作者对环戊硅烷3的底物范围进行了扩展(Figure 3)。苯环的取代基不受电子效应影响,均可获得所需的苯并环庚硅烷产物4b-41。同时,多取代底物的同样取得较好的结果,获得多取代产物4m-4q。此外,环己基甲醇和苯酚都作为有效的亲核试剂,可用于获得产物4r-4s。而将溴和环戊硅烷基团引入到萘的1位和8位上,可获得八元硅环产物4t。
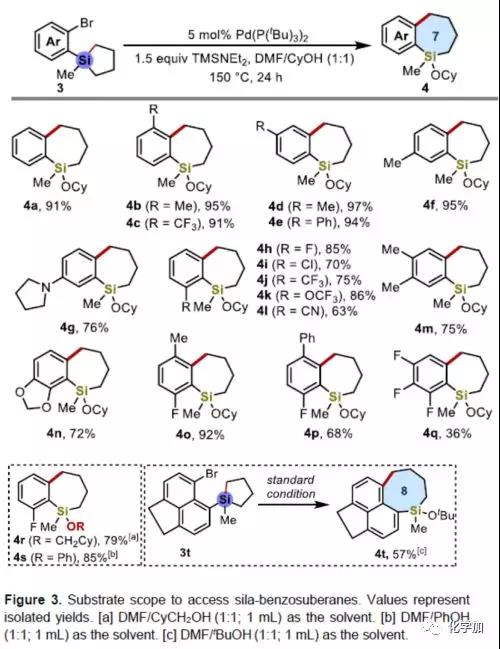
(图片来源:Angew. Chem. Int. Ed.)
为了进一步证明该方法的实用性,作者对获得的产物4h进行了相关的后期修饰(Figure 4)。如4h在40%HF的THF/H2O溶液中室温反应1小时,导致-OCy基团裂解,获得98%收率的产物5a,同时4h中-OCy基团很容易通过有机锂试剂进行烷基取代,得到产物5b(79%)。如果使用tBuOOH/SeO2可在DCM中进行水解,获得85%收率的硅烷醇5c。另外,可以用LiAlH4还原产物4h中Si-O键,得到环状氢硅烷5d(产率为71%,可用作氢化硅烷化反应的合成中间体)。除了还原外,还可以将4h在Tamao氧化条件下,以80%的产率获得2-羟基芳基丁醇5e(生物活性分子的中间体)。而使用NIS/AgF与4h反应,即可实现开环和二碘化反应,以56%的产率获得1-碘-2-(4-碘丁基)苯5f。

(图片来源:Angew. Chem. Int. Ed.)
此外,作者也对产物中的碳环进行了进一步的官能团化,从而获得多种含硅四氢萘或苯并环庚硅烷衍生物(Figure 4)。首先,在产物5b的5位上进行溴化反应,以70%的产率得到溴化产物6。产物6可进一步修饰,如在DMSO中,化合物6可以平稳地进行氧化,以58%的产率获得溴化的硅烷基-苯并环庚硅烷醇7。而在DBU的存在下,可以容易地消除6中的溴,形成不饱和的苯并环庚硅烯8。8也可作为一种良好的反应中间体,用于多种转化,如通过PCC或DDQ进一步氧化,可获得相应的硅烷基-酮9或共轭体系产物10。

(图片来源:Angew. Chem. Int. Ed.)
为了进一步了解反应机理,作者进行了一些对照实验。首先,作者使用环己硅烷11作为底物,在上述两种标准条件下反应(Eq. 1-2),均未发生扩环,从而说明分子内Pd-催化硅的交叉偶联反应中,硅环的高环张力是必不可少的。如果不使用Pd0催化剂(Eq. 3),环丁硅烷1x在标准条件未发生反应,表明1x在tBuOH中没有形成游离的五配位硅中间体。同时,如果在化学计量的Pd(PtBu3)2(Eq. 4)存在下,将底物13在标准条件下反应,仅获得100%的原料,表明环丁硅烷在经历分子内的转金属化之前是不活泼的。此外,环丁硅烷13与芳基溴化物14之间的竞争实验还阐明了C-Br键的氧化加成比C-Si键的插入快得多,且反应从C-Br键的氧化加成开始,因为在化学计量的Pd(PtBu3)2存在下,14的二聚反应顺利地生成了化合物15(Eq. 5)。
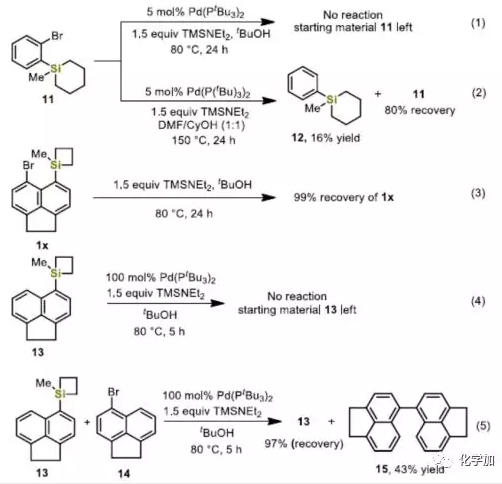
(图片来源:Angew. Chem. Int. Ed.)
根据上述实验和相关文献的查阅,作者提出了一种可能的反应机理(Figure 5)。首先将Pd0氧化加成至1或3的C-Br键,形成PdII中间体A,再经分子内转金属化,从而获得中间体B(Path A),随后在ROH和碱存在下进行分子间醚化反应,从而获得Si-OR键的中间体C,最后经还原消除,获得目标产物2或4,并再生Pd0催化剂。值得注意的是,碱和HOR存在下,PdII中间体A还可以经另一种Br/OR交换途径获得Ar-PdII-OR物种B',然后在PdII-OR键和C(sp3)-Si键之间经σ-键复分解也可获得中间体C(Path B)。
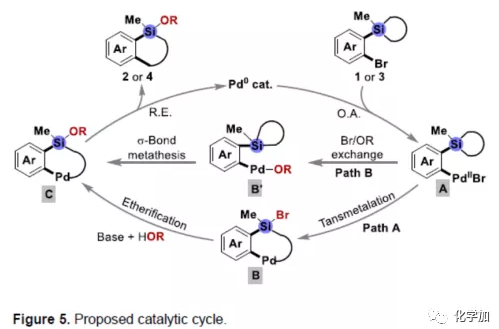
(图片来源:Angew. Chem. Int. Ed.)
总结:南开大学赵东兵课题组报道了基于Pd-催化硅的交叉偶联反应,实现了一种高效且通用的扩环方法,可通过环丁(戊)硅烷底物经扩环合成多种六-八元硅环衍生物,该反应具有良好的的官能团耐受性,也是合成多种含硅的四氢化萘以及苯并环庚硅烷衍生物最有效和通用的方法之一。