导语:氘代作为标记技术在反应机理的研究,药物的吸收,分布,代谢和排泄(ADME)研究,核磁共振光谱和质谱分析研究中具有重要的作用。近年来,在药物分子中引入氘原子,在保持药物基本药理活性的同时,以增强其代谢和药代动力学特性的研究得到快速的发展。2017年FDA批准了第一个氘代药物丁苯那嗪(Austedo)进入市场。与丁苯那嗪母体相比,氘代丁苯那嗪具有更长的半衰期,药代动力学特征得到明显的改善,由此氘代药物在制药行业的需求日益增加,这极大地推动了氘代反应方法学的研究。近日,南开大学汪清民教授课题组在这一领域取得重大突破,他们将氢原子转移光催化剂与有机小分子硫醇催化剂结合起来,使用氘代水做氘源实现了醛类化合物高选择性地氘代反应。该方法能够对医药、农药和天然产物进行后期氘代修饰,为氘代药物的研发提供了一种高效实用的方法。相关研究成果发表于Chem. Sci., 2020, DOI: 10.1039/C9SC05132E.
前沿科研成果:
醛在药物和有机合成中无处不在,并且醛基可以通过特定的化学转化得到多种其他的结构单元。氘代醛可作为理想的氘代合成砌块,用于构建更为复杂的分子结构。因此发展高效的合成方法得到氘代醛具有重要的意义。氘代醛目前的合成方法包括LiAlD4还原相应的酯后再氧化,Schwartz试剂(由LiAlD4制备)还原相应的酰胺,Pd/Rh-共催化还原羰基化反应,光催化和有机小分子协同催化下羧酸的脱氧氘代反应(图1A)。考虑到有机合成中的原子和步骤经济性,制备氘代醛最理想的方法是氢氘交换反应(HIE)。在这一方法学领域,已经报道了几例Ir-和Ru-催化的HIE反应,但是这些反应的氘代率不高且区域选择性不好,往往会得到芳香环C-H键氘代的副产物(图1B)。此外,将氘原子引入到结构复杂的醛中也是有机合成中的挑战。考虑到氘代醛的重要性,作者希望开发一种新的反应模式,以氘代水作为氘源,实现高效、原子和步骤经济性的甲酰基选择性的HIE反应。此外,作者希望这种新的HIE反应能够适用于结构复杂的醛的后期氘代。
可见光催化近年来在有机合成中得到快速地发展。最近,MacMillan课题组报道了光催化下三级胺分子氮邻位碳氢键的HIE反应。使用有机小分子硫醇作为氘原子转移催化剂转移氘原子是该反应成功的关键。作者希望通过氢原子转移的策略由醛产生酰基自由基,再通过硫醇催化氘原子转移的策略实现醛的选择性氘代反应。金属钨的(Bu4N)4[W10O32]盐(TBADT)是一种常见的氢原子转移(HAT)金属催化剂(由钨酸钠一步反应制备),它能够攫取惰性碳氢键的氢原子产生烷基自由基。由于苯甲醛芳环上碳氢键的键能(113 kcal/mol)比醛基碳氢键的键能(94 kcal/mol)要高很多,这将确保(Bu4N)4[W10O32]光催化剂能够选择性地攫取醛基的碳氢键产生酰基自由基。而常见硫醇催化剂硫氢键的键能(80-88 kcal/mol)比醛基碳氢键的键能要低,因此产生的酰基自由基能够快速攫取硫氘的氘原子得到氘代醛,并且该过程也符合自由基攫氢过程中的极性匹配原则(图1C)。因此将(Bu4N)4[W10O32]光催化剂与有机小分子硫醇催化剂结合起来提供了一种自由基HIE交换的策略合成氘代醛的方法,到目前为止,(Bu4N)4[W10O32]光催化剂与硫醇催化剂协同催化模式还未曾报道过。本文中作者报道了一种光催化和有机小分子协同催化下使用氘代水做氘源的醛甲酰选择性地氘代反应(图1D)。温和的反应条件、高的氘代率、广泛的底物适用范围、良好的官能团兼容性使得该反应特别适合于对药物分子进行后期氘代修饰。
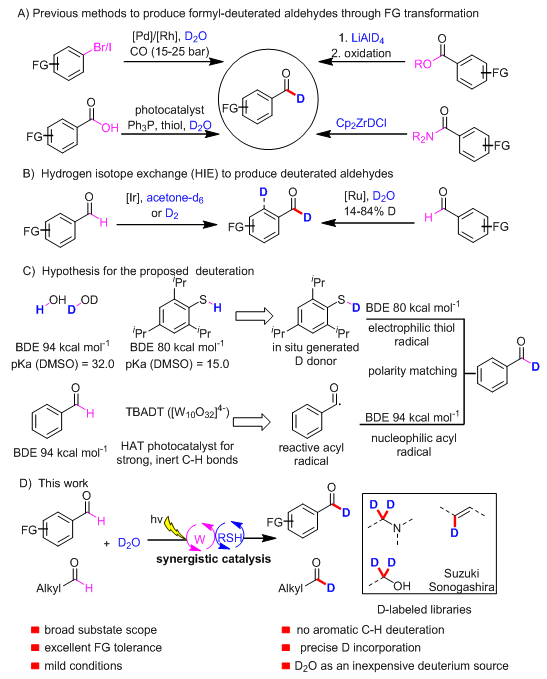
图1 氘代醛和合成方法
作者以2-萘甲醛(1a)做反应底物,TBADT做光催化剂,二氯甲烷和氘代水做反应溶剂对反应条件进行了筛选(表1)。首先作者对硫醇催化剂进行了筛选,当使用2,4,6-三异丙基苯硫酚(7a)时,反应4天能够以94%的氘代率得到目标产物10a(entry 1)。当使用其他的硫醇催化剂时,反应的氘代率有所降低(entry 2–4)。随后作者对反应溶剂进行了筛选,当使用N-甲吡咯烷酮、乙腈和氯仿与氘代水做反应的混合溶剂时,反应的氘代率均会降低(entry 5–7)。降低TBADT光催化剂的量到2 mol%,以77%的氘代率得到产物(entry 8);降低硫醇催化剂7a的当量到20 mol%,以80%的氘代率得到产物(entry 9)。最后作者进一步做了控制实验,该反应在没有光催化剂、没有硫醇催化剂或者没有光照的条件下均不能发生(entry 10–12)。至此得到了最佳的反应条件:4 mol%的TBADT做HAT光催化剂,40 mol%的2,4,6-三异丙基苯硫醇(7a)做硫醇催化剂,二氯甲烷和氘代水做反应混合溶剂反应4天。
表1 反应条件的筛选a
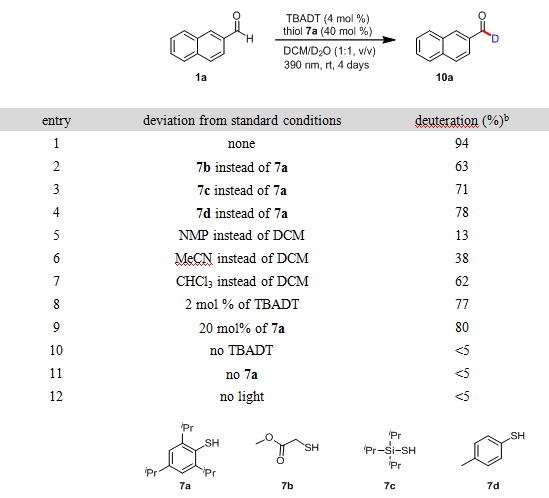
aReaction conditions, unless otherwise noted: 1a (0.3 mmol), TBADT (0.012 mmol), 7a (0.12 mmol), and 1:1 (v/v) DCM/D2O (3.0 mL) under Ar atmosphere.bDeuterium incorporation was determined by integration of the residual formyl proton in the 1H NMR spectrum. DCM = dichloromethane, NMP = N-methyl-2-pyrrolidinone.
在最优的反应条件下,作者对该反应的底物适用范围进行考察(表2)。10a能够以92%的分离收率得到,这说明氘代产物在柱层析时不会发生分解。6-甲氧基-2-萘甲醛能够以92%的氘代率得到目标产物(10b)。而1-萘甲醛以90%的氘代率得到产物(10c),相对较低的氘代率可能是由于该底物的位阻较大,而TBADT光催化剂攫取醛基氢原子的过程受位阻效应的影响。为了进一步考察该反应的官能团兼容性,作者对苯环上带有各种各样取代基的苯甲醛类底物进行了考察(10d–10bb)。具体为,苯环上带有中性基团如异丙基、叔丁基和苯基取代基能够以很好的氘代率得到目标产物(10d–10f)。并且苯环上带有卤素取代基如氟、氯、溴、碘也能以较好的氘代率得到氘代产物(10g–10k)。三氟甲基和三氟甲氧基对于改进药物的性质具有重要作用,作者发现三氟甲基和三氟甲氧基在反应体系中也能够兼容(10l–10o)。吸电子基如酯基、氰基以及供电子基如甲氧基、醚和胺取代的苯甲醛也能以较高的氘代率得到氘代产物(10p–10v)。更为重要的是,一些敏感的官能团如硼酸、炔基、烯基同样能够兼容(10w–10z)。同时,多取代的苯甲醛也能适用于该反应(10bb and 10bb)。考虑到杂芳环类化合物在药物分子中广泛存在,作者对含有杂芳环的醛类底物也进行了考察。作者发现含有吡啶、吲哚、喹啉、噻唑等杂芳环的醛同样能够适用于该反应得到较高氘代率的氘代产物(10cc–10gg)。
除了芳香醛,脂肪醛组成了醛类化合物的绝大部分。然而,通过自由基HIE的策略实现脂肪醛的氘代反应是很困难的。因为产生的酰基自由基很容易脱去一分子CO得到烷基自由基。对于脂肪醛化合物,该方法同样适用,并以较高的收率和氘代率得到氘代产物(10hh–10mm)。
为了进一步验证该方法的适用性,作者对复杂的醛分子和药物进行后期氘代修饰。薄荷醇、孕奶烷醇、布洛芬和芬布芬衍生的醛能够以较高的氘代率得到氘代产物(10nn–10qq)。抗痤疮药物阿达帕林也能以很高的氘代率得到后期氘代的产物(10rr)。这进一步说明了该方法的适用性。
表2 底物适用范围
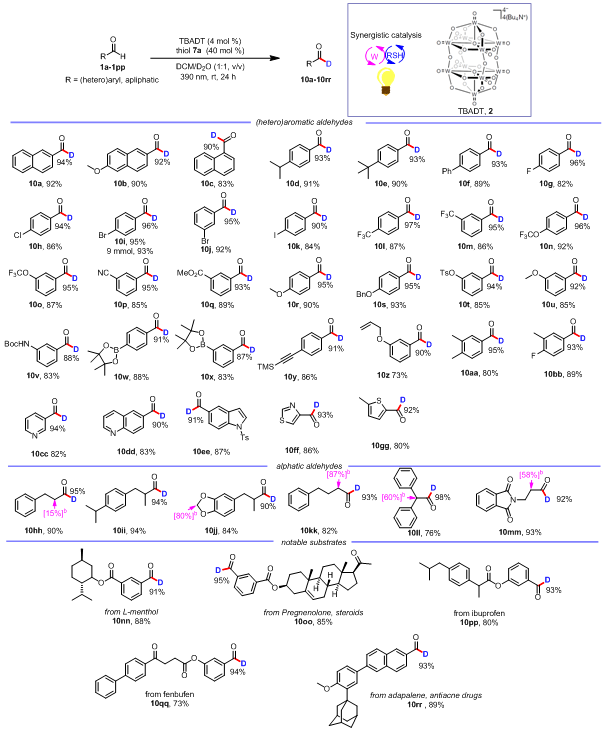
aReactions were performed on a 0.3 mmol scale, unless otherwise noted. bSome sites in compounds 10hh, 10jj, 10kk, 10ll and 10mm (shown in their structures, with the deuteration percentage in square brackets) are deuterated. Isolated yields are given. See the Supporting Information for experimental details. Deuterium incorporation was determined by integration of the residual formyl proton in the 1H NMR spectra.
为了进一步验证该方法的实用性,作者对氘代产物进行转化,得到一系列氘代有机化合物(图2A)。作者从氘代产物10i出发,通过还原反应、还原氨化反应和Horner-Wadsworth-Emmons烯基化反应分别得到氘代醇(11)、氘代胺(12)和氘代烯烃(13)。其中得到的氘代烯烃13是通过其他方法无法得到的。从氘代产物10i出发,还可以通过Suzuki偶联反应和Sonogashira偶联反应引入芳基和炔基官能团。
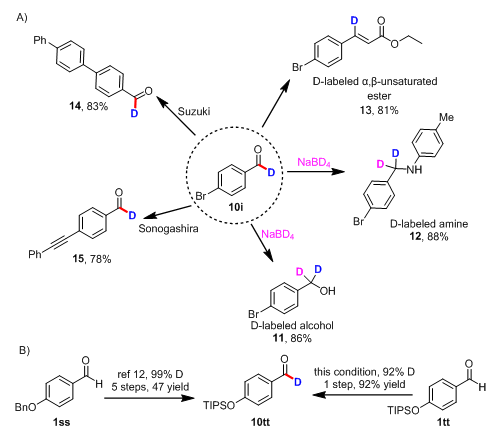
图2 后期转化
随后作者对该方法在提高合成效率方面的应用进行了考察(图2B),作者从硅基保护的对羟基苯甲醛(1tt)出发一步就可以得到氘代产物1tt,而在之前报道的方法中需要从苄基保护的对羟基苯甲醛(1ss)出发五步才能得到氘代产物10tt。
在探索了反应的底物适用范围和反应的应用性后,作者对反应的机理进行研究(图3)。当加入2.5当量的自由基捕获基TEMPO时,仅仅以10%的氘代率得到产物10a,同时以12%的收率得到相应的酰基自由基被TEMPO捕获的产物(16)。当使用丙烯酸苄酯做自由基捕获基时,相应被捕获的酰基自由基(18)以16%的产率分离得到。当作者使用4-甲酰基吡啶做反应底物时,没有分离得到氘代产物,而是以84%的收率得到酰基自由基与硫自由基偶联的产物(19)。这些机理实验证明了反应体系中有酰基自由基和硫自由基的产生。
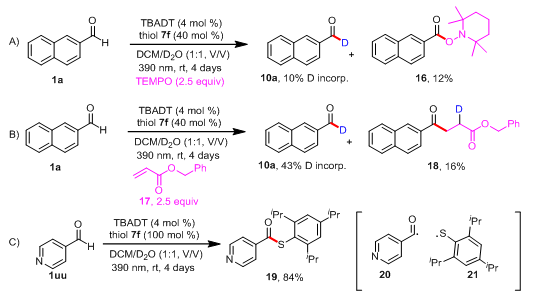
图3 机理实验
随后作者对自由基HIE反应合成氘代醛的策略提出了下面的机理过程(图4)。首先光催化剂在光照下激发产生*[W10O32]4-(3),3选择性攫取2-萘甲醛(1a)醛基的氢原子得到酰基自由基(5)和[W10O32]5-H+(4)。于此同时体系中的硫醇催化剂(7)与氘代水发生氢氘交换得到氘代硫醇(8),酰基自由基(5)攫取氘代硫醇(8)的氘原子得到产物氘代醛(10a)和硫自由基(9),硫自由基9将4氧化完成光催化和硫醇催化的循环。
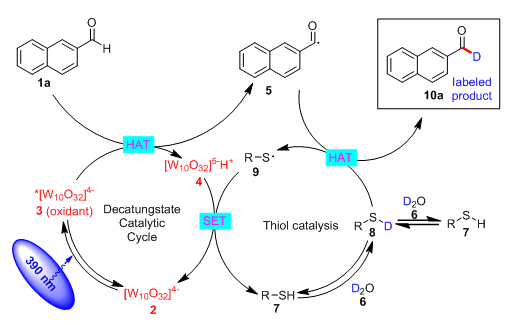
图4 提出的反应机理
总结:汪清民教授课题组发展了一种光和有机小分子协同催化下使用氘代水做氘源的醛甲酰选择性地氘代反应。该反应避免了芳环上氘代副反应的发生,经过后期转化能够得到多种氘代有机化合物。温和的反应条件、高的氘代率、广泛的底物适用范围、良好的官能团兼容性使得该反应特别适合于对药物分子进行后期氘代修饰,为氘代药物的研发提供了一种高效实用的方法。
本篇工作通讯作者为南开大学的汪清民教授。南开大学博士研究生董建洋为该论文的第一作者,南开大学副研究员刘玉秀、讲师宋红健、硕士研究生王皛琛和王振对该工作的顺利进行也做出了重要贡献。上述研究工作得到了国家自然科学基金重点项目(21732002,21672117) 和南开大学化学学院博士生科研创新计划项目的资助。谨献礼陈茹玉院士诞辰100周年和南开大学百年校庆!
文章链接:https://pubs.rsc.org/en/Content/ArticleLanding/2020/SC/C9SC05132E#!divAbstract