
导语:氮杂芳环广泛存在于天然产物、药物分子、有机材料及配体中。通过选择性碳氢键官能团化的方式对氮杂芳环进行后期修饰具有重要意义。在酸性和氧化条件下,自由基对氮杂芳环的加成反应,即Minisci反应,提供了一种很高效地合成烷基取代的氮杂芳环的方法。但Minisci反应往往需要过量的氧化剂和酸以及很高的温度,这大大限制了底物的适用范围。到目前为止Minisci反应中用于产生自由基的前体化合物主要包括羧酸、活化和未活化的烷烃、硼酸、亚磺酸盐、卤代烃、醇、胺。但是使用自然界中广泛存在且含量丰富的醛和酮作为烷基自由基来源的Minisci反应却未有报道,其挑战在于反应需要断裂碳氧双键并且羰基化合物与氮杂芳环的极性不匹配。近日,南开大学汪清民教授课题组在这一领域取得重大突破,他们将光催化条件下的质子迁移电子耦合(PCET)过程和生物体中的自旋中心迁移(SCS)过程结合起来,实现了由醛或酮作为烷基自由基等价体的Minisci碳氢键烷基化反应。该方法能够对医药、农药、天然产物和有机材料进行后期官能团化修饰,为新药和新材料的研发提供了一种高效实用的方法。相关研究成果申请发明专利,并发表于Sci. Adv. 2019, 5 : eaax9955.
前沿科研成果:
在有机化学领域,羰基化合物常常作为关键的合成子合成具有复杂结构的分子。羰基化合物参与的反应类型如:Grignard反应、Wittig反应、还原胺化反应等均是将羰基化合物作为碳正离子等价体的反应。通过极性反转的方式也可以实现羰基化合物作为碳负离子等价体的反应。但羰基化合物脱氧作为烷基自由基等价体的反应却从未实现(图1A)。因此,将羰基化合物作为亲核性的烷基自由基来参与有机化学反应无疑将丰富羰基化合物的反应性,使得其在合成中的应用更加广泛。
生物体中进行着各种各样的自由基反应,其中质子迁移电子耦合(PCET)是生物体中一种非常重要的活化醛和酮的过程。最近,Knowles课题组报道了一系列光催化的PCET过程实现醛和酮向羰游基的转化(图1B)。脱氧核糖作为DNA的合成单元,是由核糖通过自由基脱氧过程合成的。该过程的关键一步在于羰游基发生自旋中心迁移(SCS)脱去一分子水得到脱羟基的产物(图1C)。
南开大学汪清民教授课题组在Minisci反应方面做了一系列开创性的工作(Sci. Adv. 2019, 5: eaax9955;Chem. Sci. 2019, 10, 976; Org. Lett. 2019, 21: 5728; Org. Lett. 2018, 20, 5661; Org. Chem. Front. 2019, 6, 2902; J. Org. Chem. 2019, 84, 7532.)。考虑到光催化条件下的PCET过程和生物体中进行的SCS过程的高效性,南开大学汪清民教授课题组将光催化条件下的质子迁移电子耦合(PCET)过程和生物体中进行的自旋中心迁移(SCS)过程结合起来,通过PCET过程活化羰基得到羰游基,羰游基对氮杂芳环加成后再通过SCS过程断裂C-O键来实现羰基化合物脱氧的Minisci反应(图1D)。
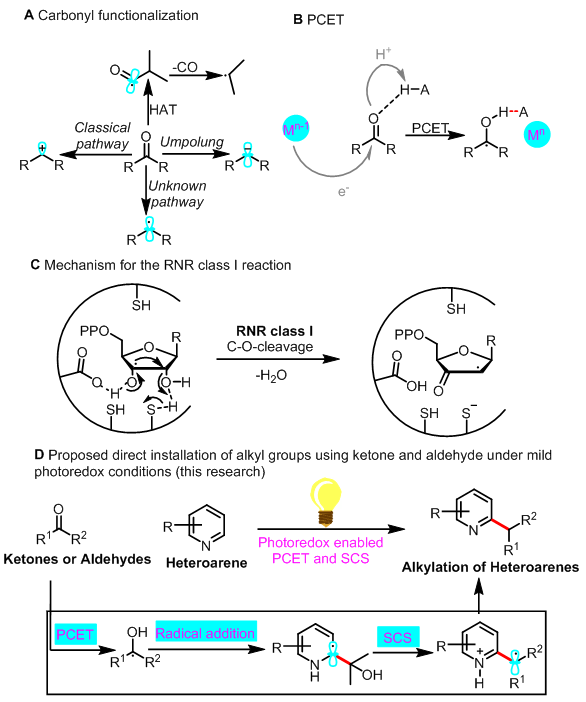
图1 羰基化合物脱氧的Minisci反应
作者以4-羟基喹唑啉和丙酮(溶剂)作为反应底物,筛选了多种光催化剂和还原剂。当使用Ir[dF(CF3)ppy]2(dtbbpy)PF6(1 mol%)作为光催化剂,三-(三甲基硅基)硅烷(TTMS 2.0 equiv)作为还原剂,TFA作为质子源时反应能以96%的核磁收率得到目标产物12。随后作者以环己酮为烷基化试剂对反应溶剂进行筛选,得到乙腈是最优的反应溶剂。作者进一步做了控制实验,该反应在没有光照、没用光催化剂、没有酸以及没有还原剂的条件下均不能发生。值得注意的是,反应使用TTMS作为还原剂是非常重要的,因为常用的胺类还原剂会与TFA形成盐,HEH还原剂会将氮杂环给还原得到氢化的产物(表1)。
表1: 反应条件的筛选a

Reaction conditions: 4-hydroxyquinazoline (0.3 mmol), photocatalyst (0.003 mmol), reductant (0.6 mmol), TFA (0.6 mmol) and acetone (3.0 mL) under Ar atmosphere. The yield was determined by 1H NMR spectroscopy using dibromomethane as the internal standard. Reaction performed in the absence of light for entry 9. Reaction performed in the absence of photocatalyst for entry 10. Reaction performed in the absence of TTMS for entry 11. Reaction performed in the absence of TFA for entry 12. NR = no reaction.
得到最优的反应条件后,作者首先对酮和醛的底物范围进行考察,作者发现该反应对于酮和醛的适用范围较广且以中等到良好的收率得到目标产物(表2)。环状和链状的酮均能以中等到良好的收率得到目标产物(12-23),但是对于链状酮来说,随着碳链长度的增加,反应的产率逐渐降低。作者推测随着碳链长度的增加,生成的羰游基的位阻逐渐增加,这使得羰游基对氮杂芳环的亲核加成能力逐渐下降。该反应对于多种多样的醛也同样适用(24-37),而且链状醛的产率比链状酮要高,这是由于由醛形成的羰游基(二级碳)比酮形成的羰游基(三级碳)位阻要小。
随后作者对氮杂芳环的底物适用范围进行考察,该反应对于氮杂芳环的适用范围较广且以中等到良好的收率得到目标产物,反应发生在氮杂芳环上最缺电子的位置(表2)。作者首先对4-羟基喹唑啉类底物进行考察,无论是吸电子基取代还是供电子基取代的4-羟基喹唑啉均能够以较好的收率得到目标产物(38-43)。一些常见的氮杂芳环如苯并噻唑、哒嗪、4-甲氧基喹啉等也能以中等的收率得到目标产物(44-49)。吡啶类底物同样也能适用于该反应,4-苯基和叔丁基吡啶能以中等的收率得到C2位单烷基化的产物(50, 51)。这是因为单烷基化的产物50和51由于亲电性降低,很难进行双烷基化反应。2,6-二甲基吡啶能以良好的收率得到C4位烷基化的目标产物(52)。
在药物分子中引入小的官能团(甲基、乙基、异丙基、叔丁基等)对于药物化学家研究这类药物的性质具有重要的意义。为了展示这种方法的实用性,作者用该方法对一些常见的药物和天然产物进行后期官能团化研究(表2)。例如,乙托贝特能够以中等的收率得到得到吡啶环烷基化的产物53。甲吡酮是皮质醇生物合成的抑制剂,能够以35%的收率选择性得到单烷基化的产物54。米力农是磷酸二酯酶3的抑制剂和血管舒张剂,能够以41%的收率得到烷基化产物55。抗组胺药氯雷他定可在吡啶环C2位选择性烷基化得到56。
表2 反应底物范围a
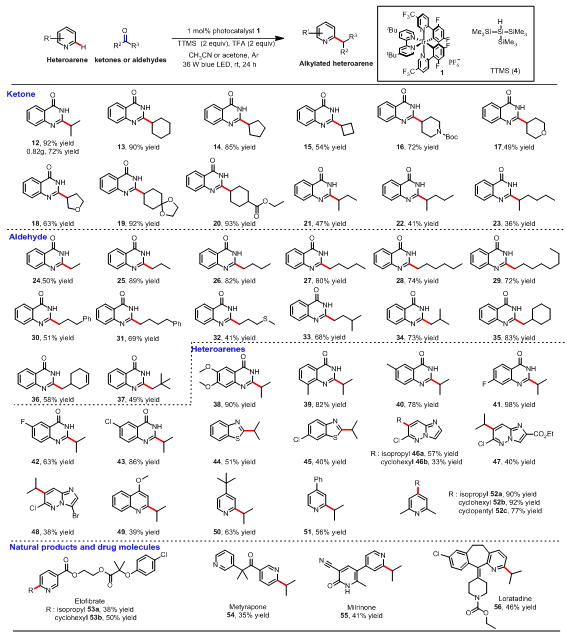
Reactions were performed on a 0.3 mmol scale, unless otherwise noted. Isolated yields are given. Using Hantzsch dihydropyridine as reductant for 48.
在探索了反应的底物适用范围和反应的应用性后,作者对反应的机理进行研究(图2)。从文献中查得TTMS的氧化电势为0.71V,而光催化剂Ir[dF(CF3)ppy]2(dtbbpy)PF6的氧化电位位1.21V,这说明三价的光催化剂Ir*3+能够将TTMS氧化成TTMS+•,同时得到强还原性的二价态光催化剂。猝灭实验证明了TTMS能够将光催化剂猝灭(图 2A)。当以57为烷基化试剂时,能够以45%的收率得到叔丁基加成的产物58,这表明相应的羰游基通过α裂解得到叔丁基自由基(图 2B)。当以59为烷基化试剂,能够以16%的收率得到乙基自由基加成的产物39, 这表明相应的羰游基通过β裂解得到乙基自由基(图 2B)。在模板反应条件下,以60作为反应底物仅仅得到微量的产物40,这说明60不是反应中间体(图 2C)。在模板反应条件下,以62作为反应底物没有检测到产物13生成,这说明62不是反应中间体(图 2C)。在模板反应条件下,不加羰基化合物,没有检测到65的生成,这说明光催化剂不能将8还原(图 2C)。在模板反应条件下,以66作为反应底物,能够以92%的收率得到产物12,这说明64是反应中间体。作者推测64被光催化剂还原得到中间体10,中间体10发生SCS脱去一分子水得到脱羟基的中间体11,11从溶剂中攫取一个氢原子得到最终产物12(图2C)。当用氘代丙酮作为反应溶剂时,以96%的收率得到苄位上氘的产物,这说明11从溶剂丙酮中攫取一个氢原子得到最终产物12(图 2D)。
图2 机理实验
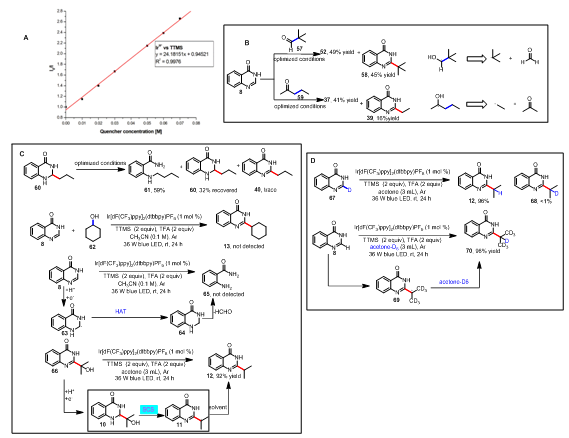
(A) Ir[dF(CF3)ppy]2(dtbbpy)PF6 emission quenching with TTMS. (B) Proving the corresponding α-oxy radicals. (C) Mechanistic studies support spin-centre shift elimination pathway. (D) Confirm the source of hydrogen atoms at the benzylic position of product.
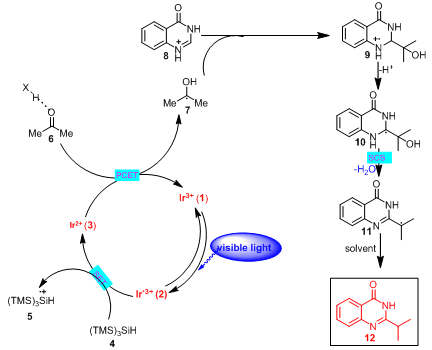
基于机理实验和相关文献报道,作者提出了如下的反应机理(图3)。在光照条件下,光催化剂被激发,激发态的三价光催化剂将三-(三甲基硅基)硅烷(TTMS)氧化成TTMS+•,同时得到强还原性的二价态光催化剂。在酸性条件下,二价态的光催化剂与羰基化合物6发生PCET过程完成整个光催化的循环,同时得到羰游基7,亲核性的羰游基7对氮杂芳环加成得到反应中间体9。反应中间体9的氮α位脱去质子得到中间体10,中间体10发生SCS脱去一分子水得到脱羟基的中间体11。11从溶剂中攫取一个氢原子得到最终产物12。
图3 提出的反应机理
总结:汪清民教授课题组将光催化条件下的质子迁移电子耦合(PCET)过程和生物体中进行的自旋中心迁移(SCS)过程结合起来,通过PCET过程活化羰基得到羰游基,羰游基对氮杂芳环加成后再通过SCS过程断裂C-O键来实现羰基化合物脱氧的Minisci反应。高的反应效率、温和的反应条件、广泛的底物适用范围和良好的官能团兼容性使得该反应特别适用于对复杂的含氮药物和天然产物进行后期官能团化修饰。这也是首例将羰基化合物作为烷基自由基等价体的反应。
本篇工作通讯作者为南开大学的汪清民教授。南开大学博士研究生董建洋为该论文的第一作者,南开大学副研究员刘玉秀、讲师宋红健、硕士研究生王振和王皛琛对该工作的顺利进行也做出了重要贡献。上述研究工作得到了国家自然科学基金重点项目(21732002) 和南开大学化学学院博士生科研创新计划项目的资助。