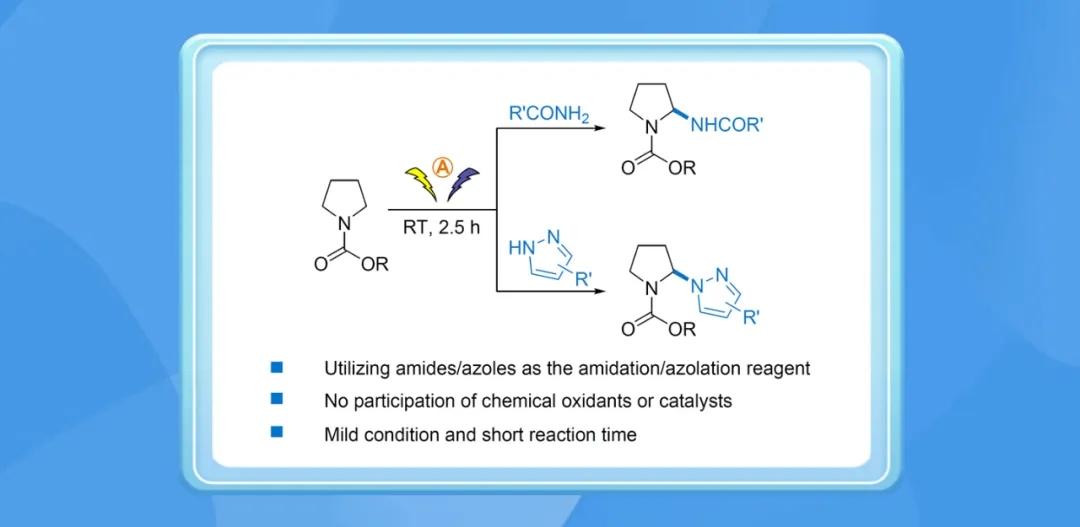
α-酰胺基酰胺类结构存在于多种天然产物、药物与精细化学品中,而烷基酰胺的α-酰胺化,是构建此类结构的一种直接方法。近年来,有多种烷基酰胺的α-酰胺化反应被报道,但这些反应往往依赖需要从相应前体合成的酰胺化试剂,其拥有较大的离去基团,在原子经济性上不利。
继2023年初发现磺酰胺、酰胺的α-四氢呋喃化反应(Green Chem., 2023, 25, 1970-1974)之后,南开大学汪清民课题组发现了一种电化学N-烷氧羰基吡咯烷的直接α-酰胺化及吡唑化反应以解决上述问题。该反应直接使用市面有售的酰胺与吡唑分别作为酰胺化、吡唑化试剂,具有高度的原子经济性。该反应适用于多种不同取代基的N-烷氧羰基吡咯烷、酰胺和吡唑,反应条件温和,无需催化剂和化学氧化剂参与。
选择N-Boc-吡咯烷(1a),4-甲基苯甲酰胺(2a)为模板底物,亚磷酸为添加剂,四丁基四氟硼酸铵为电解质,丙酮为溶剂,以石墨电极在10 mA电流下电解2.5 h后,可以90%的高收率得到α-交叉偶联产物(3a)。
该反应适用于多种不同吸电子、给电子基团取代的脂肪及芳香酰胺2,包括稠环和杂环酰胺(2o–2r),并以31–95%的产率得到相应的α-酰胺化偶联产物3。该反应同时也适用于数种氨基甲酸酯(2ad–2af)以及1,1-二甲基脲(2ag)。
令人欣慰的是,作者发现该反应亦适用于不同取代基的吡唑4,并以42–96%的产率获得相应的α-吡唑化产物5。除此之外,1,2,4-三氮唑(3o)也适用于该反应。
作者随后发现,该反应适用于多种不同的α-烷氧羰基吡咯烷以及α-芳氧羰基吡咯烷1,并以61–92%的产率得到相应产物6。
接下来,为了验证反应机理,作者采用TEMPO(2,2,6,6-四甲基哌啶氧化物)或1,1-二苯乙烯作为自由基捕获剂加入模板反应体系中。反应均被显著抑制,证明该反应经由自由基中间体的机理。
作者在反应体系中加入正丁醇作为竞争性的亲核试剂,发现α-酰胺化产物3a仍然可以39%的产率产生,而α-烷氧基化产物7仅痕量产生。因此,该反应不太可能经由亲核进攻的机理。
为了进一步探索反应机理,作者测量了1a与2a的循环伏安曲线。1a有电位在2.06 V左右的氧化峰,而2a的氧化峰较弱,电位在约2.1 V左右。当1a与2a混合后,新的氧化峰出现在1.99 V的电位,低于1a与2a各自的氧化峰。作者推断,该反应涉及到1a与2a两种底物的协同电氧化过程。
为了进一步支撑1a与2a协同电氧化的机理,作者使用N-Ms-吡咯烷(8)替代1a,或使用甲基磺酰胺(9)替代2a。当1a或2a单独被替代时,相应产物仅能以痕量检测到;但当8与9同时替代1a与2a时,该反应可以61%产率获得相应偶联产物10。循环伏安实验显示,8的氧化峰电位在约2.54 V,明显高于1a与2a,协同电氧化难以发生。加入9后,新的氧化峰电位降至2.37 V。
根据上述的实验结果,作者推测该反应经由以下机理:1在阳极上氧化生成自由基正离子A,脱质子后生成自由基中间体A’。与此同时,2在阳极上氧化生成自由基正离子B。A’与B发生偶联以及脱质子过程,生成产物3。
该研究成果发表于有机化学领域国际著名期刊Green Chemistry
(http://dx.doi.org/10.1039/D4GC01689K)。该论文第一作者为王壮博士研究生,通讯作者为汪清民教授。