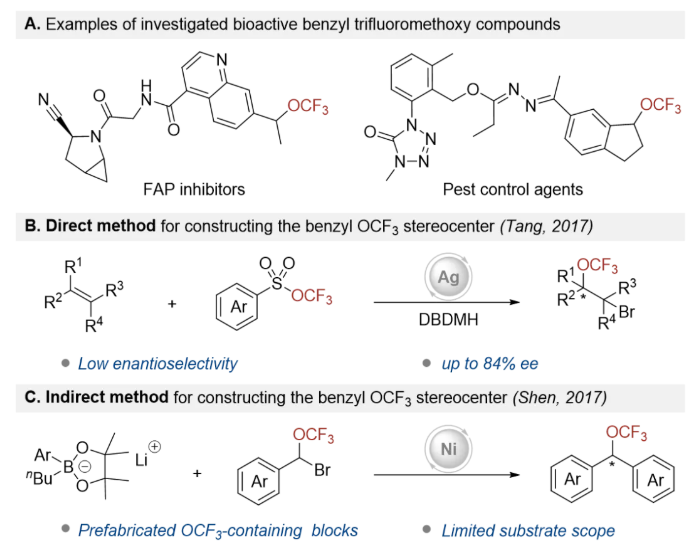
三氟甲氧基(-OCF3)官能团作为药物分子中的重要结构单元,因其能够显著提升药物的代谢稳定性和脂溶性,近年来受到广泛关注。特别是在手性药物研发领域,开发高效构建手性三氟甲氧基化合物的方法具有重要的科学意义和应用价值。然而,由于三氟甲氧基阴离子固有的不稳定性、亲核性弱,以及过渡金属三氟甲氧基物种易发生β-F消除等问题,不对称三氟甲氧基化反应面临着多重挑战。目前该领域的研究仍处于起步阶段,仅有少数几例成功案例被报道。特别是在手性苄基三氟甲氧基化合物的合成方面,现有的两种方法存在明显局限性:对映选择性控制不理想、需要预先制备含OCF3的合成砌块,以及底物适用范围窄等问题。
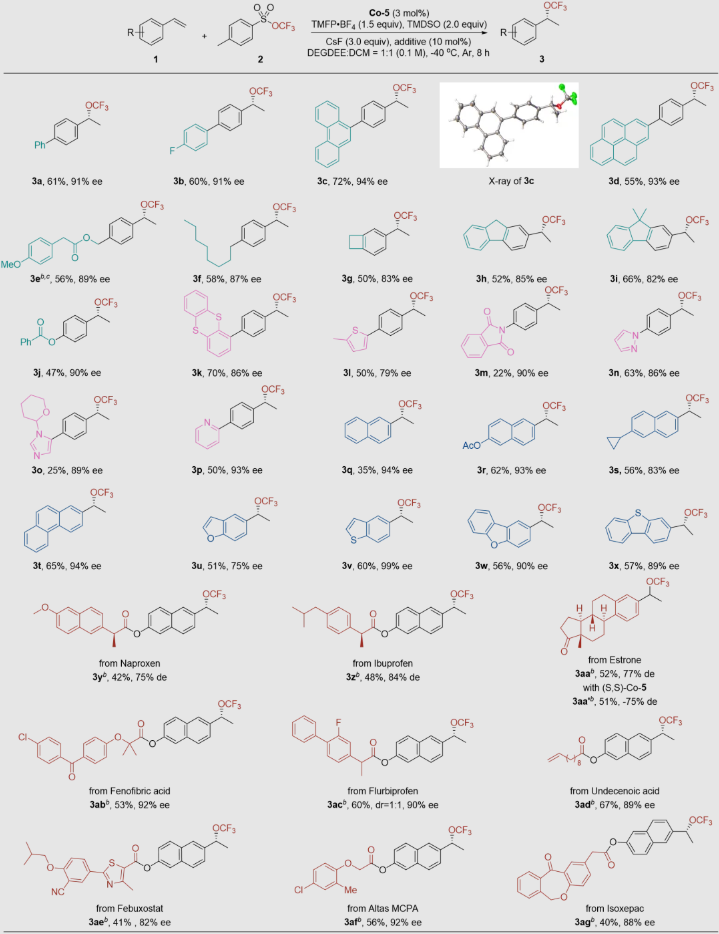
针对这一挑战,作者提出实现手性苄基三氟甲氧基化合物高效不对称合成的关键在于发展满足以下三个核心要素的催化体系:1)高反应活性体系,以克服OCF3基团固有的不稳定性;2)强亲电活化能力,以弥补OCF3较弱的亲核特性;3)可调控的立体环境,通过位阻配体设计在空间位阻较小的OCF3基团周围实现立体选择性控制。基于本课题组长期在三氟甲氧基领域的研究,近日,南开大学汤平平课题组成功开发了钴催化芳香烯烃的不对称氢三氟甲氧基化反应,高效构建了一系列具有光学活性的苄基三氟甲氧基化合物,为手性三氟甲氧基化合物的合成提供了新的思路和方法。

该方法的底物普适性良好,一系列芳基、烷基、杂芳基(噻蒽、噻吩、吡唑和吡啶等)取代的苯乙烯衍生物均能够很好地兼容该反应体系。此外,乙烯基萘、乙烯基蒽以及苯并杂芳烃等底物也能顺利参与反应,以良好的收率和对映选择性生成相应的苄位三氟甲氧基化合物。此外,该方法还适用于由生物活性分子衍生的烯烃底物,如萘普生、布洛芬、非布索坦和雌酮等,这充分展示了该方法在药物发现和开发中的重要应用前景。
基于初步的机理研究,作者提出了可能的机理循环。首先,salen配位的Co(II)催化剂与氧化剂和硅烷氢化物的反应原位生成关键的LCoIIIH物种。随后,CoIIIH介导的氢原子转移(HAT)与烯烃反应生成自由基催化剂对A,进而形成烷基Co(III)物种B。该烷基Co(III)物种B随后经历单电子转移(SET)氧化,生成烷基Co(IV)中间体C。最后,烷基Co(IV)中间体与OCF3亲核试剂的反应通过类似SN2的亲核取代反应进行,生成目标产物,并同时释放Co(II)进入下一个催化循环。
小结
汤平平团队发展了首例钴催化的芳香烯烃与三氟甲基芳基磺酸酯(TFMS)的分子间不对称氢三氟甲氧基化反应。该方法反应条件温和、官能团兼容性优异、底物适用范围广泛,为手性苄基三氟甲氧基化合物的高效立体选择性合成提供了全新途径。相关成果发表在Angewandte Chemie International Edition 上。南开大学化学学院汤平平教授和栾玉新副教授为共同通讯作者,博士生司亚峰为文章的第一作者。
原文(扫描或长按二维码,识别后直达原文页面):

Cobalt-Catalyzed Enantioselective Hydrotrifluoromethoxylation of Aromatic Alkenes
Yafeng Si, Yuntao Liu, Fan Zhou, Lei Fang, Kang Wu, Yu-Xin Luan, Li Chen, Pingping Tang
Angew. Chem. Int. Ed., 2025, DOI: 10.1002/anie.202501680