烷基胺的反应活性主要由氮原子的亲核性决定,但也具有独特的氧化还原能力。尤其是,烷基胺可脱氢成为亚胺,水解后可生成醛或酮。这一过程可以为烷基胺的惰性碳位置提供反应机会,实现胺和羰基化合物之间便捷的“跨越”(图1a)。
虽然非氧化还原N-H取代反应已经得到广泛发展,但利用烷基胺的氧化还原反应性生成亚胺依然有着很大的挑战。从机理上讲,烷基胺脱氢的关键在于惰性C-H键的裂解。为实现这种惰性C-H键裂解,化学家们探索了各种策略,包括使用邻位二羰基试剂进行去质子化(
H
+转移)、氢原子转移(HAT)或单电子转移/去质子化以及金属催化的氢负(
H
-)转移反应(图1b)。除了金属催化途径外,烷基胺中的氢负转移也可以在没有金属辅助的情况下以分子内反应的形式进行。虽然近年取得了不错的进展,但化学家对胺的分子内氢负转移的机理理解仍然有限,通过分子间氢负转移实现烷基胺无金属脱氢的实用方法仍然难以实现。

图1. 通过分子间氢负转移实现烷基胺的脱氢转化。
图片来源:
JACS
近年来,
南开大学陈弓课题组报道了多种基于简单醛类试剂的高效且有选择性的复杂多肽修饰方法(
Angew. Chem. Int. Ed.
2021,
60, 6646;
J. Am. Chem. Soc.
2022,
144, 10080;
Angew. Chem. Int. Ed.
2024, DOI: 10.1002/anie.202318893),其中六氟异丙醇(HFIP)溶剂与甲醛(HCHO)进行搭配组合,可有效交联肽上附近位置的赖氨酸(Lys)和酪氨酸(Tyr)的侧链,还能通过四氢三嗪单元将赖氨酸和精氨酸(Arg)的胍基侧链交联在一起,形成亚甲基连接产物。尽管HFIP溶剂在提高交联反应活性方面发挥了关键作用,但这种促进作用的机制并不清楚。在这些研究过程中,作者发现了一个有趣的现象:在室温下,HFIP作为溶剂,利用HCHO处理含有Lys但缺乏Tyr及Arg残基的肽底物(如五肽
1)时,会产生少量
N-甲基化产物
1a,丙烯醛
1b以及其他副产物(图2a)。作者推测:
N-甲基化产物
1a是通过底物
1和醛亚胺
1c之间的同源分子间氢负转移形成的。在这一过程中,
1充当氢负供体,而
1c则充当氢负受体。
1c被还原成
1a,生成的亚胺中间体
1e会发生水解,生成醛
1f,醛
1f与另一分子HCHO发生Aldol缩合反应后生成
1b。
近日,
陈弓课题组开发了
甲醛-六氟异丙醇搭配的新“魔术”,成功激发烷基胺α C-H键的氢负释放潜力,使得烷基胺在温和条件下的分子间氢负转移反应成为可能(图1c)。作者以吡咯烷作为外部氢负离子供体,烷基伯胺在室温下通过醛亚胺中间体(氢负离子受体)进行选择性
N-甲基化反应;将反应条件调整为中性或弱碱性,烷基伯胺(氢负离子供体)可以通过氢负离子直接转移到HCHO(氢负离子受体)进行选择性脱氢,生成亚胺并进一步转化为其它羰基产物。机理研究表明,HFIP溶剂介导的大环过渡态可以通过负超共轭作用并采用最佳构象激活胺的
α C-H键。
基于赖氨酸氨基侧链独特的负氢性(hydricity),作者引入环状仲烷基胺(吡咯烷,4当量)作为氢负供体,HFIP作为溶剂,并在室温下与肽底物
1,aq. HCHO(3当量)反应4小时后,以高效率、高选择性得到
N-甲基化产物
1a(条件[A],见图2b中的LC-trace-2)。
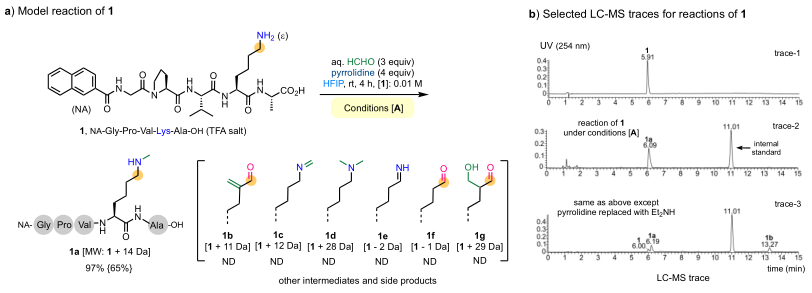
图2. 肽1赖氨酸侧链N-甲基化的优化。图片来源:JACS
目前烷基伯胺的单选择性
N-甲基化修饰方法大多需要使用保护基来阻断其中一个N-H键。这种必要性增加了其合成成本,并限制了在肽等复杂分子后期修饰中的应用。而作者的HCHO/吡咯烷/HFIP方案提供了一种便捷高效的后期修饰方法(图3a),可在标准条件[A]下将甲基单选择性地引入到具有不同组成和长度的肽的氨基侧链上。此外,氘代标记实验表明吡咯烷是氢负供体。动力学同位素效应(KIE)为3.1,表明吡咯烷的
α C-H裂解是分子间氢负转移反应的决速步骤。如图3c所示,
N-甲基化条件也可以很好地用于各种伯烷基胺底物。值得注意的是,反应后简单的纯化处理提供了一种高效实用的方案来制备带有游离C
O
2H基团的
N-甲基氨基酸,而不需要任何柱色谱纯化:在减压下去除反应混合物中的HFIP溶剂,随后用乙醚研磨,即可获得纯度(>95%)和单选择性均极高的所需产物。
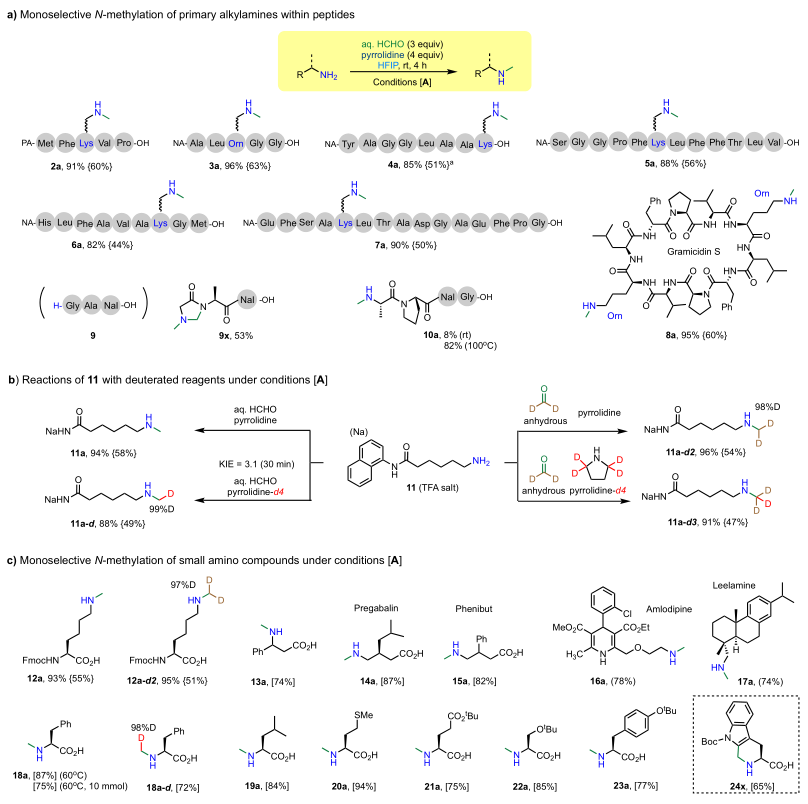
图3. 烷基伯胺的单选择性
N
-甲基化的底物范围。
图片来源:
JACS
碱或胺添加剂的选择对HCHO介导的分子间氢负转移反应有显著影响。在所测试的常见伯胺和仲胺添加剂中,没有一种能够通过产生合适的醛亚胺中间体(作为氢负受体)来实现赖氨酸(氢负供体)的高效和选择性脱氢转化。作者发现在DIPEA等碱存在下,并提升温度至100 ℃,脱氢产物
1b的收率明显提高,达到76%(条件[B],图4a,LC曲线)。外部胺的不添加表明赖氨酸的氨基侧链是唯一的氢负供体,而HCHO本身成为最有效的氢负受体。这种由HCHO介导的脱氢缩合反应提供了一种前所未有的方法,可将赖氨酸的亲核氨基侧链转化为带有两个潜在反应位点的亲电丙烯醛基团,并可进一步衍生化。

图4. 肽1的脱氢Aldol缩合反应优化。图片来源:JACS
如图5a所示,赖氨酸的脱氢反应对多种肽底物都有效。原则上,C反应位点受阻的烷基胺的脱氢反应可以在亚胺或醛阶段停止。如图5b所示,作者发现苄胺可以与HCHO反应生成苯甲醛,而且收率很高。该脱氢水解反应对多种苄基伯胺(
37f-39f,41f-43f)具有良好的反应效果。具有缺电子取代基的苄胺的反应活性较低(见
40f)。以底物
50为例,仲苄基烷基胺在条件[C]下通常不能很好地发挥作用。但是,烷基胺添加剂的加入可以显著提高反应效率。在所研究的烷基胺中,加入3当量的aq. MeN
H
2的效果最好。作者推测,MeN
H
2和HCHO反应生成的醛亚胺中间体是比HCHO更好的氢负受体,更有利于接受氢负离子,提高反应活性。
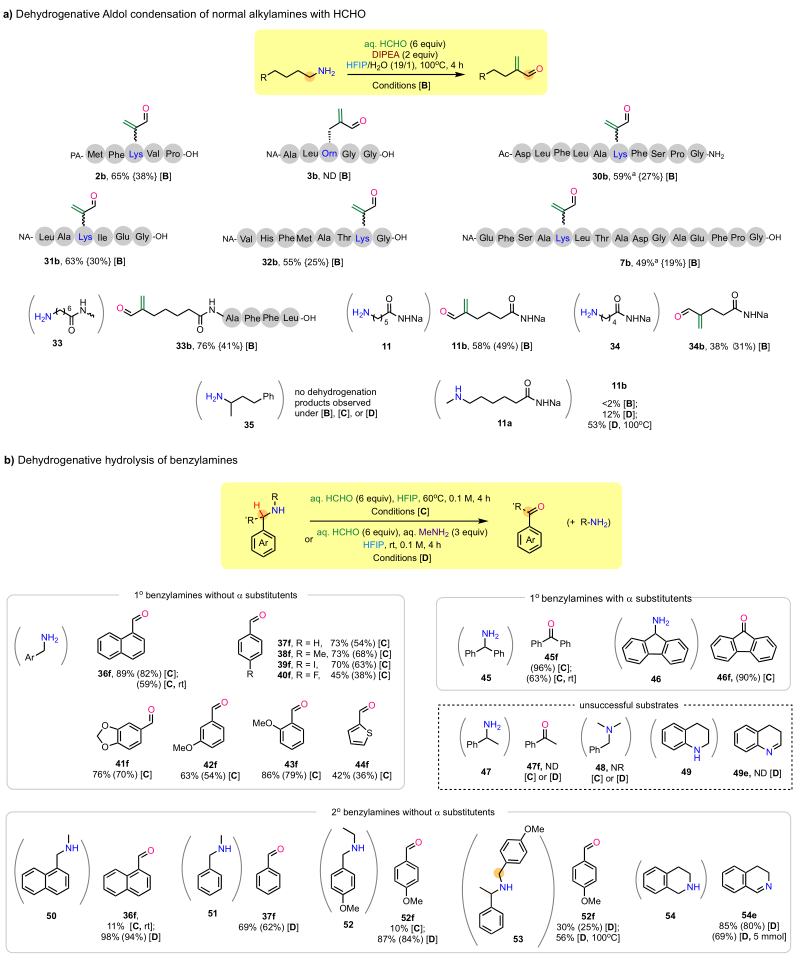
图5. HCHO介导的烷基胺脱氢反应。图片来源:JACS
如图6a所示,烷基伯胺会和其产生的醛亚胺中间体之间发生同源氢负转移,生成
N-甲基化和脱氢后的混合物。作者将这种
无金属参与的氢负和质子转移过程命名为
H2T。在homo-H2T反应中,胺发挥着双重作用,通过醛亚胺中间体来作为氢负受体和氢负供体。为了实现这种HCHO-HFIP搭配的“魔术”,必须以hetero-H2T方式优先考虑胺的双重作用之一。在作者的
N-甲基化反应中,加入具有较强氢负释放能力的吡咯烷可以有效将烷基胺的反应引向hetero-H2T途径,在该途径中,烷基伯胺只作为氢负受体。相反,在作者的脱氢缩合反应中,利用碱和升高的反应温度可以引导烷基胺的反应沿着另一种hetero-H2T路径进行,其中烷基伯胺作为氢负供体,HCHO作为氢负受体。
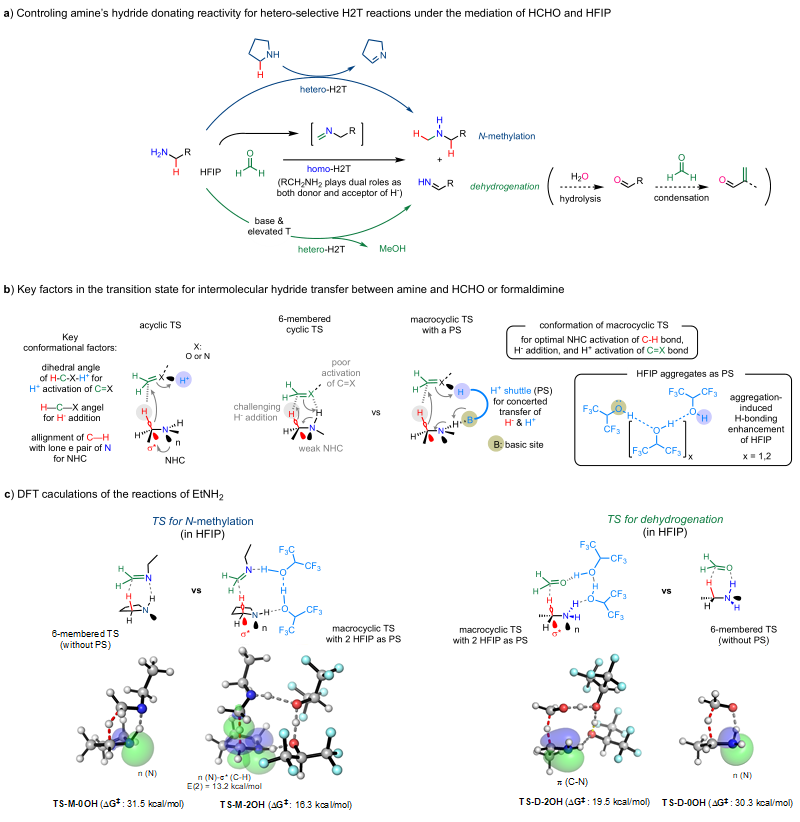
陈弓课题组与
中国科学院上海有机化学研究所薛小松课题组合作,通过密度泛函理论(DFT)对反应进程进行了计算研究(图6b, 6c)。机理计算研究发现,这些分子间氢负转移过程的关键在于HFIP溶剂介导的大环过渡态的参与。这些过渡态可以容纳多种微妙而重要的轨道相互作用,促进氢负和质子的协同转移。尤其是采用适当的构象,可以促进氮的孤电子对(n)与胺的
α C-H键的反键轨道(*)之间产生强烈的负超共轭作用,从而有效激活
α C-H键,促进氢负的释放。其中HFIP分子的聚集体在大环过渡态中作为质子穿梭体,发挥着关键作用。在HFIP聚集体的促进下,这些大环过渡态的参与可能对在HFIP中进行的其他各种反应具有更广泛的影响。
陈弓教授课题组开发了一种无金属参与的分子间氢负转移策略,通过在HFIP溶剂中用HCHO进行简单处理,在温和条件下将氢负从烷基胺中释放出来。该策略可实现小分子和复杂肽的高效和选择性转化,展示了利用烷基胺氧化还原反应性的新可能性。这一成果近期发表在
Journal of the American Chemical Society 上,南开大学博士生
蔡少坤、唐虹、李博为该论文的共同第一作者,通讯作者为南开大学
陈弓教授和中国科学院上海有机化学研究所
薛小松教授。
Formaldehyde-Mediated Hydride Liberation of Alkylamines for Intermolecular Reactions in Hexafluoroisopropanol
Shaokun Cai, Hong Tang, Bo Li, Yingbo Shao, Danqi Zhang, Hanliang Zheng, Tianjiao Qiao, Xin Chu, Gang He, Xiao-Song Xue*, and Gong Chen*
J. Am. Chem. Soc.
, 2024, DOI: 10.1021/jacs.3c12215