P–N或P=N键广泛存在于各类生物活性分子、配体以及催化剂中。传统的构筑P–N键方法主要有两种,分别是有机膦与叠氮化合物的Staudinger反应以及胺对膦卤化合物的亲核取代反应。这两类方法所使用的原料具有潜在的爆炸性或较大的毒性,限制了其在合成中的应用。理论上讲,基于膦亲核试剂与氮亲电试剂的取代反应,将会为含P–N化合物的合成提供一种高效简洁的方法。由于氮亲电试剂的种类较为缺乏,导致这种策略的发展一直较为缓慢。
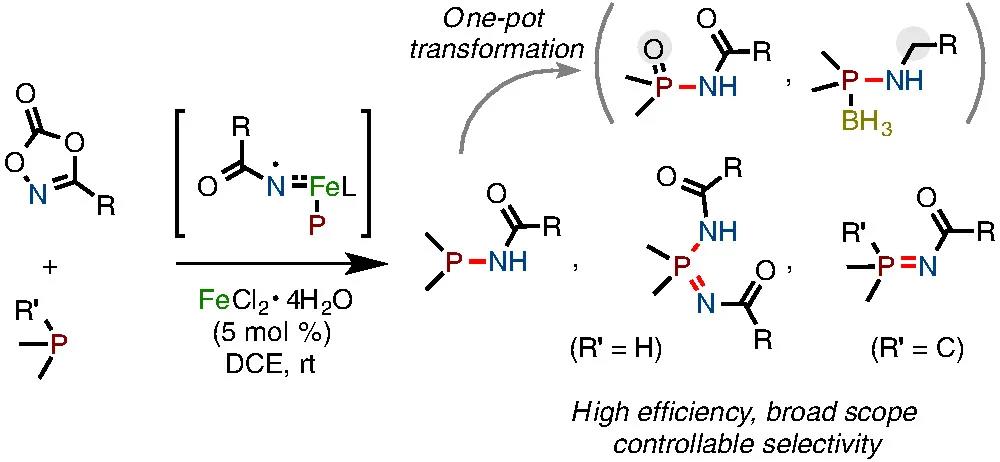
图1. 铁催化氮宾参与的P-N键偶联反应
二噁唑酮作为一种简单易得的氮宾前体,被广泛应用于各种亲电胺化反应中(ACS Catal. 2020, 10, 4751-4769)。1968年,Sauer和Mayer首次报道了二噁唑酮可由羧酸化合物经过两步反应高效合成,并发现二噁唑酮化合物在光或热的作用下可以通过脱除CO2,生成酰基氮宾,与二甲基亚砜发生氮宾转移反应,生成N-乙酰磺酰亚胺(Tetrahedron Lett. 1968, 9, 319-324)。2014年,Bolm课题组以钌配合物作为光催化剂,实现了二噁唑酮对亚砜或硫醚的胺化反应(Angew. Chem. Int. Ed. 2014, 53, 5639-5642)。2018年,Chang教授课题组使用二噁唑酮作为氮宾前体,在铱催化作用下,通过脱除CO2,形成铱氮宾中间体,随后经由协同插入机理(CMD),实现分子内C–H键胺化反应(Science 2018, 359, 1016-1021)。最近,陈弓教授课题组与Chang教授课题组合作,以二噁唑酮作为氮宾前体,在[Cp*IrCl2]2或FeCl2的催化下,实现了金属氮宾与N-烷基芳胺的N-N偶联反应,合成了一系列酰基肼类化合物。机理研究表明,N-烷基芳胺通过N-H键与催化剂中氯原子相互作用,实现了芳胺对铱氮宾中间体的亲核进攻构筑N-N键(Nat. Chem. 2021, 13, 378-385)。
受到上述硫醚/亚砜胺化及N–N偶联反应的启发,作者猜想,能否利用二级膦(R2PH)作为亲核试剂,实现其对金属氮宾中间体的捕获进而构筑P–N键?初步尝试证实了作者的猜想。作者通过条件优化,发现FeCl2·4H2O (5 mol%)作为催化剂,二噁唑酮 (1 equiv),R2PH (2 equiv),DCE为溶剂时为最优条件。由于产物遇空气及柱层析易被氧化,作者在反应完成后向体系中加入BH3·THF (2 equiv),可得到稳定的酰胺基膦产物d (Condition [A])。如果加入过量的BH3·THF (5 equiv)会将产物d中的羰基还原,得到胺基膦产物e (Condition [B])。如果将二噁唑酮的量增加至2.5 equiv,可选择性得到亚胺基膦酰胺b (Condition [C])。(如图2)。
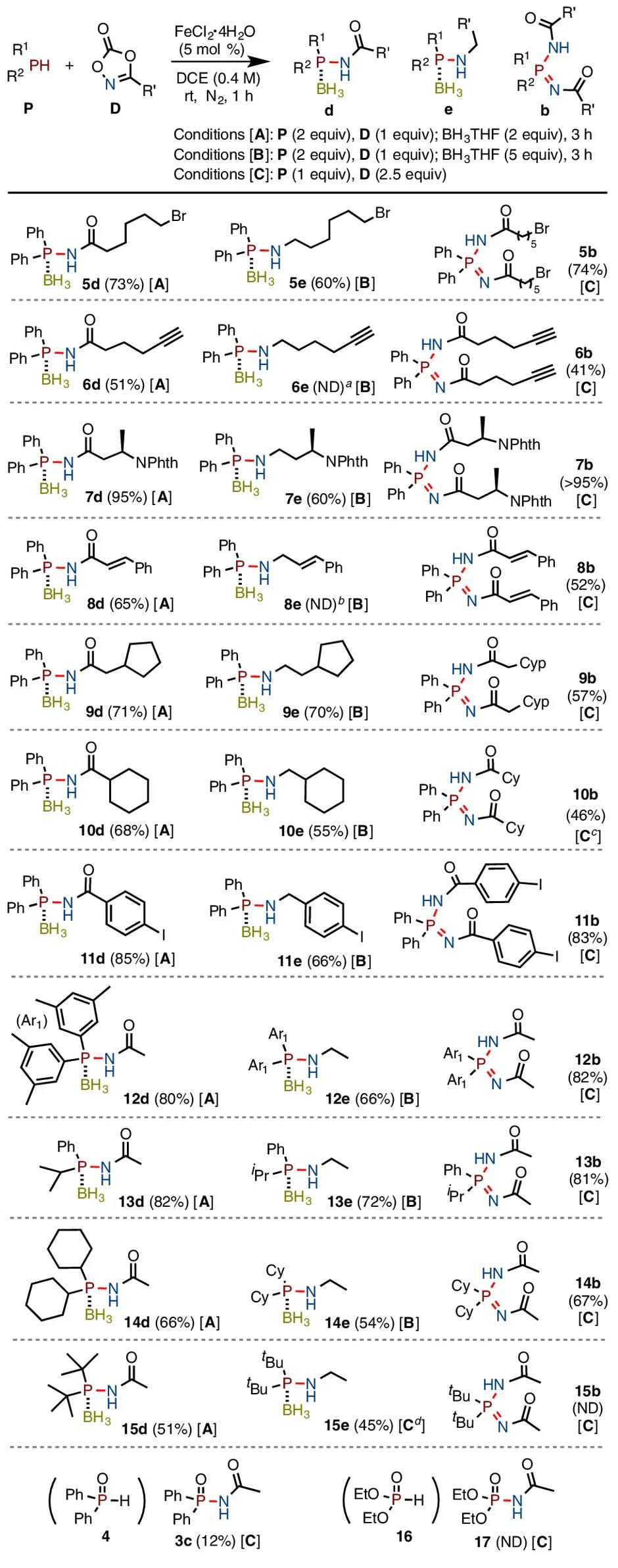
图2. 二级膦及二噁唑酮底物范围考察
基于此最优条件,作者对底物适用范围进行了考察。对于3-取代二噁唑酮,普通烷基(5, 9)、芳基(11)、卤素(5)、烯基(8)、炔基(6)、NPhth (7)等均能较好的容忍,但过量的硼烷会将烯烃、炔烃还原而得不到e类胺基膦化合物(6e, 8e)。对于二级膦底物,非对称的苯基异丙基膦可顺利进行(13),二环己基膦也能以中等收率得到目标产物(14)。该反应对位阻较为敏感,随着二噁唑酮位阻的增大,反应活性降低。如对于3-环己基二噁唑酮,即使在高浓度下,也只能以较低的收率得到双胺化产物(10b)。二叔丁基膦无法顺利转化为双胺化产物(15b)。对于二苯基膦氧化合物4,反应活性大大降低,只能以12%收率得到目标化合物(3c)。亚磷酸二乙酯化合物活性进一步降低,不能得到目标产物(17)。作者推测,R2P(O)H类化合物可能由于膦的亲核性及配位性较弱,无法实现对氮宾的有效捕获。
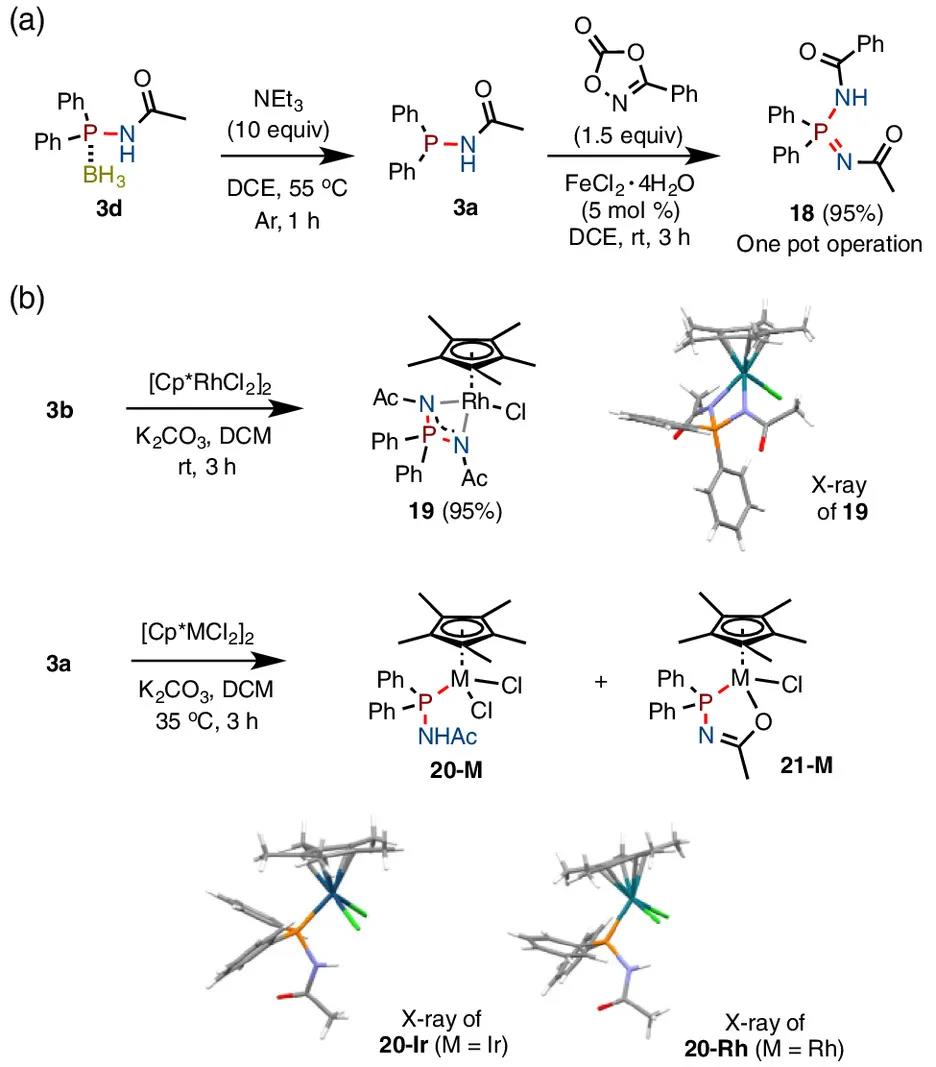
图3. 非对称双胺化产物及金属配合物的合成
随后作者尝试一锅法合成非对称双胺化产物(图3)。化合物3d与Et3N作用可原位脱除BH3,在铁催化下进一步与另一分子二噁唑酮反应,可得到非对称的双胺化产物18。双胺化产物可作为(PN2)双氮配体与金属配位,如化合物3b,在碱的作用下可与[Cp*RhCl2]2络合,得到Cp*(PN2) Rh配合物19。酰胺基膦产物可作为膦配体或膦-氧配体与金属配位,如产物3a与[Cp*RhCl2]2或[Cp*IrCl2]2络合可分别得到混合物20-M及21-M。产物比例受温度影响较大,如20-Rh/21-Rh: 1/1.6 (35 ℃), 1/9 (55 ℃)。该实验结果表明,胺基膦结构可作为支撑配体与过渡金属形成稳定的配合物。
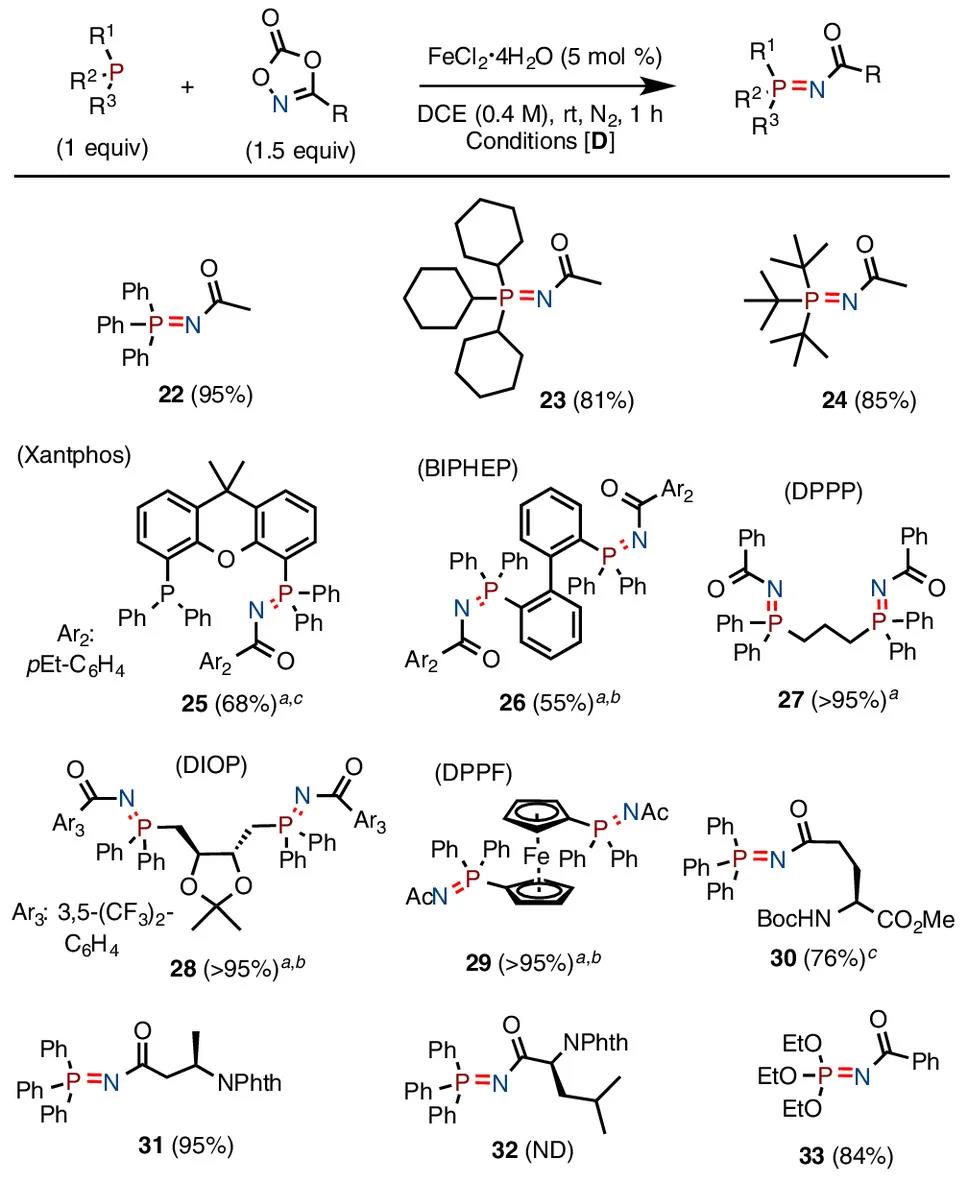
图4. 三级膦底物与二噁唑酮底物范围考察
随后作者考察了三级膦与二噁唑酮的反应性(图4),铁催化下,三苯基膦、三环己基膦均能与3-甲基二噁唑酮顺利发生胺基化反应,得到相应的亚胺基膦化合物(22,23),位阻更大的三叔丁基膦,也能以85%收率得到目标化合物24。随后作者尝试对一系列有机膦配体进行胺基化修饰,均以中等至优秀的收率得到目标产物(25-29)。反应受二噁唑酮位阻影响较大,Cα-取代二噁唑酮无法得到目标产物32。对于三烷氧基取代的膦如亚磷酸三乙酯,反应可以84%收率得到目标化合物33。
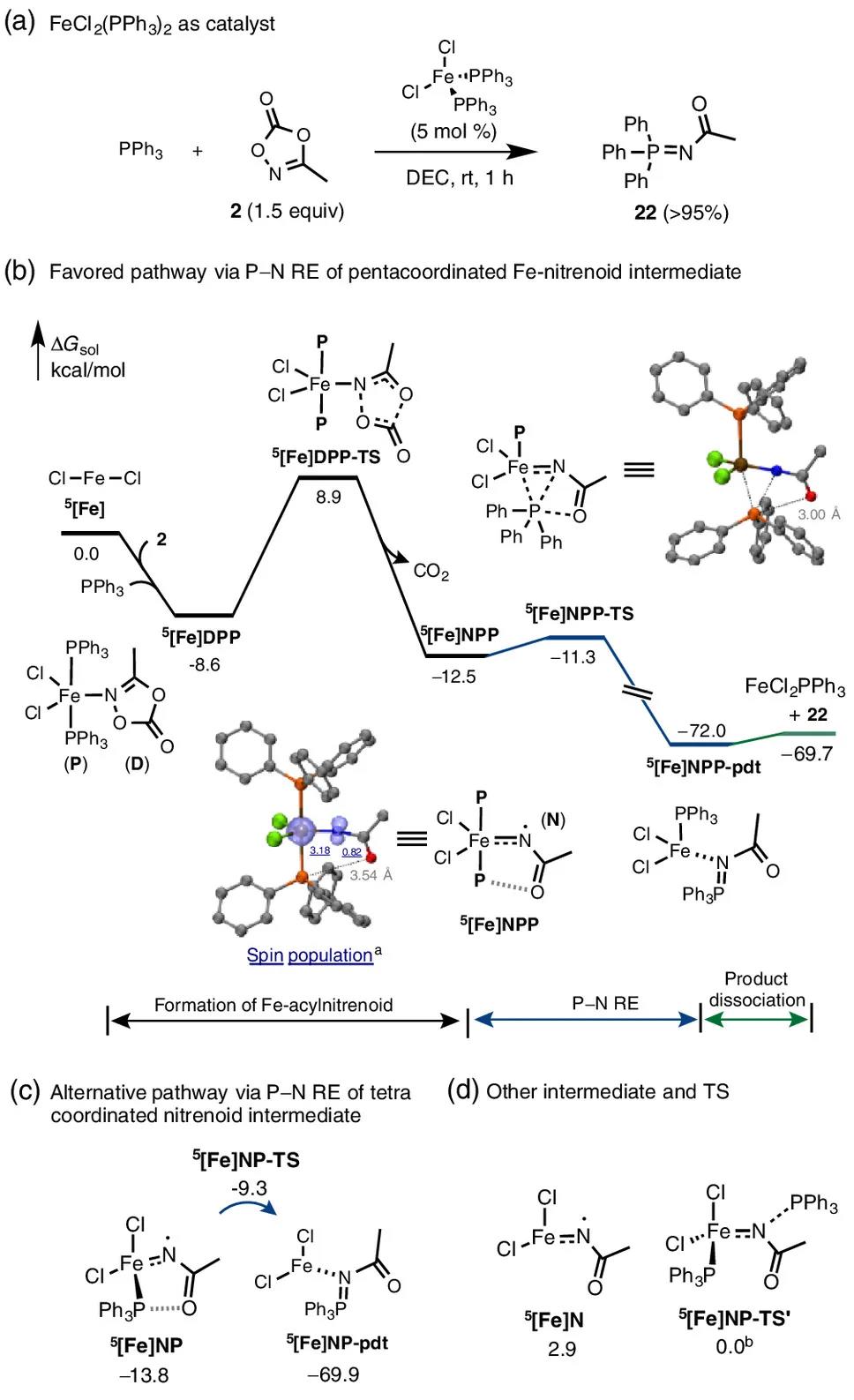
图5. DFT机理研究 (Gaussian-16, A03, (U)PBE0-D3(BJ)/Def2-TZVPP (SMDDCE)//(U)PBE0-D3(BJ)/Def2-SVP (gas))
作者通过DFT计算对反应机理进行了详细研究(图5)。FeCl2与FeCl2·4H2O具有相似的反应性,为简化条件,作者以FeCl2、PPh3、3-甲基二噁唑酮为模型底物对机理进行了研究。计算结果表明,五重态具有较低的势能面。最优反应途径如图5b所示,首先FeCl2与底物配位生成5[Fe]DPP,其经历过渡态5[Fe]DPP-TS脱去CO2得到酰基氮宾中间体5[Fe]NPP;该中间体易发生还原消除,经由过渡态5[Fe]NPP-TS得到P–N偶联产物,该过程能垒仅为1.2 kcal/mol;随后产物从金属中心解离完成催化循环。进一步对关键过渡态5[Fe]NPP-TS进行弱相互作用分析发现,该结构中存在较强的P···O相互作用,从而较大程度上降低了还原消除过程的能垒。作者计算了其他可能的反应路径,如图5c,单膦配位历程其还原消除对应的过渡态5[Fe]NP-TS势能为-9.3 kcal/mol,与较为有利的双膦配位历程仅相差2.0 kcal/mol,因而该途径可能会作为竞争历程生成目标产物。如图5d,PPh3对5[Fe]N中间体的外球亲核进攻过程,过渡态势能为0 kcal/mol,为反应的次要途径。
综上所述,南开大学陈弓课题组发展了一种铁催化氮宾参与的P–N偶联反应,反应以简单易得的二噁唑酮作亲电试剂,含膦化合物为亲核试剂,实现了温和条件下多种含P–N化合物的高效合成。机理研究表明,首先磷原子通过孤对电子与铁氮宾中间体配位以后发生还原消除构筑P-N键。该工作以Communication的形式发表在CCS Chemistry,已在官网“Just Published”栏目上线。值得提到的是,大连理工大学包明教授,于晓强教授团队早前也报道过相关氯化铁催化N-P成键反应的专利(CN109762017)并与近期发表了对此反应体系的进一步研究 (Angew. Chem. Int. Ed. 2021, 60, 16426-16435)。