
含有手性季碳的茚环结构广泛存在于各类药物活性分子以及有机材料中,如何发展高效的方法来立体选择性合成这类化合物一直以来备受关注。近日,南开大学叶萌春课题组通过手性铝协同金属镍催化C-CN键活化domino环化反应,简洁高效地实现该类化合物不对称合成。相关工作在线发表于Angew. Chem. Int. Ed. (DOI: 10.1002/anie.202001142)。
由于茚环张力以及季碳位阻,含有手性季碳的茚环化合物很难通过茚环的直接官能化反应来构建。相比之下,利用过渡金属催化的多步串联反应直接合成茚环结构相对更加容易,近期受到更多的重视。西北大学的栾新军教授(J. Am. Soc. Chem. 2015, 137, 4876),上海有机所的游书力教授(J. Am. Soc. Chem. 2015, 137, 4880)以及英国诺丁汉大学的Lam教授(Angew. Chem. Int. Ed. 2015, 54, 13975),分别以C-Br键和C-H键活化为起点,通过过渡金属钯或铑催化的去芳构化反应合成该类化合物。反应的立体选择性通过手性NHC配体或手性茂配体控制。与之不同的是,叶萌春课题组首次以C-CN键活化为起点,通过镍催化烯烃环化的方法实现该类化合物不对称合成,并获得了优异的立体选择性。此外,该反应的另一个突破在于:使用双金属Ni/Al、非手性单膦配体和柔性的Taddol二醇,实现了Ni催化C-CN活化反应的立体选择性控制。由于Ar-Ni-CN的线性结构及同时占用了Ni的两个配位点,导致之前该类反应的立体控制很难通过手性单齿配体或者手性双齿配体进行较好的控制,仅有的几个例子也都局限于分子内反应,且底物结构受到了较大的限制。该柔性双金属催化反应体系为这类线性结构底物的不对称控制提供了一个很好的解决办法。

图一 含季碳茚的不对称催化合成 (来源:Angew. Chem. Int. Ed.)
以氰基化合物和炔烃为原料,通过对手性二醇以及三芳基膦进行筛选,作者最终选用酒石酸衍生的手性二醇和(4-MeOC6H4)3P配体为最优组合,获得了86%的收率和92% ee。在最优条件下,作者对底物的适用性进行考察。各类如甲氧基,三氟甲氧基,烯丙基,氯,酯等官能团在反应中都可以兼容。同时,作者对烯基链上取代基也进行考察,甲氧基或苄氧基等取代基对反应立体选择性并没有太大影响。
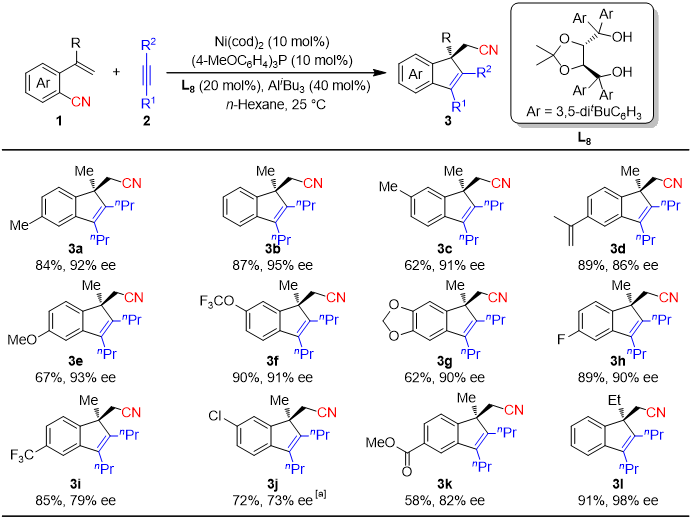
图二 底物适用性考察 (来源:Angew. Chem. Int. Ed.)
最后,作者通过控制实验和计算化学对反应的机理进行验证。根据计算结果,作者推测反应机理:1)CN与Al配位,活化C-CN键,生成中间体int0;2)Ni(0)对C-CN键氧化加成,同时与体系中炔烃配位生成中间体int1;3)炔烃迁移插入,生成中间体int2;4)烯烃迁移插入同时体系中另一分子炔烃与金属Ni配位,生成中间体int3;5)还原消除生成产物以及int0,实现整个催化循环。通过吉布斯自由能的比较,作者推测反应立体选择性控制应该是由炔烃的迁移插入以及烯烃的配位这一步(int1至int2)决定,而不是传统的手性原子生成步(int2至int3)决定。接着,通过立体模型,对中间体int2进行研究,烯烃H与Taddol中芳环π键作用以及Al与膦配体中芳环π键作用决定产物以S构型为主。
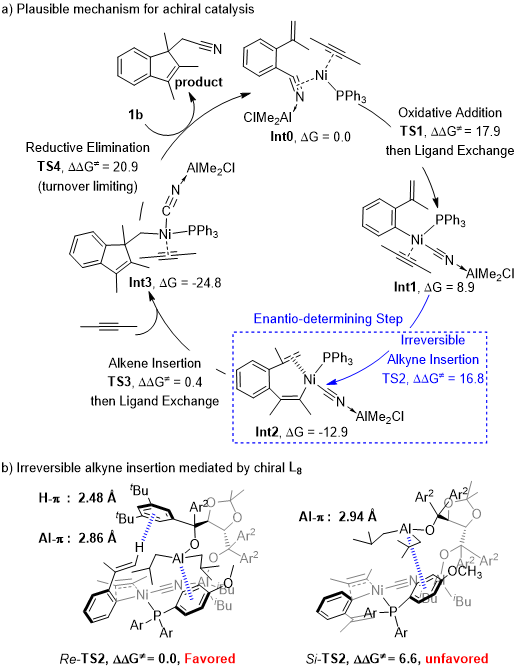
图三 反应可能机理 (来源:Angew. Chem. Int. Ed.)
综上所述,该课题组通过镍催化C-CN键活化domino反应高效构建含有手性季碳的茚化合物,一步生成三个C-C键。同时,作者采用一种有别于传统过渡金属的不对称催化方法,通过手性Al试剂与非手性膦配体的共同作用,实现反应立体选择性的控制。
实验部分工作由博士研究生张涛同学完成,理论计算部分由彭谦老师及其课题组的郑素娟同学,以及叶萌春课题组的栾玉新博士共同完成。研究工作得到国家自然科学基金(21871145, 91856104, 21672107, 21890722和21702109),天津市自然科学基金(19JCZDJC37900, 18JCYBJC21400, 19JCJQJC62300),天津市研究生科研创新项目(2019YJSB081)和中央高校基础研究经费,南开大学(63191601, 63191515, 63196021)的支持。