手性分子的对映体往往表现出截然不同的生物活性,在医药、农药、香料和材料领域中有广泛的应用。不对称催化是合成手性分子单一对映体的高效方法。目前,大部分不对称催化反应的手性控制都是通过催化剂与底物的空间相互作用实现的。当底物的反应中心连有两个空间位阻非常相似的取代基时,手性催化剂很难区分它的潜手性面,反应的对映选择性通常不高,这是不对称催化领域的普遍性难题(图1)。
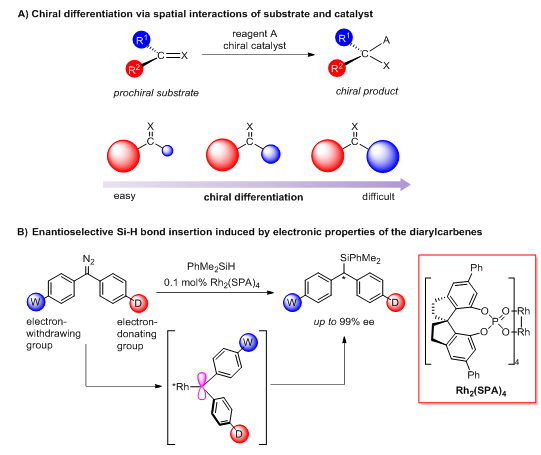
图1. 潜手性面的识别及双芳基卡宾对硅氢键的不对称插入反应
许多反应活性中间体,包括卡宾、碳正离子,碳负离子、碳自由基,由于取代基的电性不同会有不同的构象。受此启发,南开大学周其林院士和朱守非教授团队设想通过合适的催化剂识别和固定这种构象,并进行后续转化,就有可能实现这些活性中间体参与的反应的手性控制。这对于取代基位阻差异较小的潜手性反应活性中间体的手性转化尤为重要。基于这一设想,他们发展了一种新颖的手性螺环磷酸双铑催化剂,首次实现了双芳基卡宾对硅氢键的高对映选择性插入反应。该反应的特点是,即使卡宾的两个芳基取代基位阻差异极小,只要存在电性差异,就能给出很高的对映选择性。加州大学洛杉矶分校Houk教授团队对这个不对称催化反应进行了计算化学研究,发现手性螺环磷酸双铑催化剂能够很好地识别和固定双芳基卡宾的构象,并能有效地控制后续硅氢键插入反应的对映选择性。相关工作发表在JACS上,南开大学博士生杨亮亮是文章第一作者,加州大学洛杉矶分校学生Declan Evans为文章第二作者 (Enantioselective Diarylcarbene Insertion into Si−H Bonds Induced by Electronic Properties of the Carbenes, L.-L. Yang, D. Evans, B. Xu, W.-T. Li, M.-L. Li, S.-F. Zhu, K. N. Houk, Q.-L. Zhou, J. Am. Chem. Soc., 2020, DOI: 10.1021/jacs.0c04725)。
在最优反应条件下,作者评价了一系列具有不同电性取代基的双芳基卡宾,包括一个芳基上有取代基的卡宾和两个芳环带有不同取代基的卡宾(图2和图3)。当卡宾两个芳环对位取代基的Hammett常数差值(Δσp)大于0.5时,反应的对映选择性大于90% ee。即使取代基的空间位阻几乎相同,只要电性差异足够大,反应依然能够取得高对映选择性。这一结果充分地说明双芳基卡宾中间体的电性差异决定了反应的对映选择性。

图2. 单取代双芳基卡宾对硅氢键的不对称插入反应

图3. 二取代双芳基卡宾对硅氢键的不对称插入反应
为了解释电性对反应对映选择性的影响机制,作者进行了计算化学研究。为了简化计算,避免催化剂空间位阻造成的影响,他们首先选择四甲酸双铑催化剂(Rh2(O2CH)4)作为模型催化剂,计算了二芳基卡宾对硅氢键插入反应的过渡态。结果显示反应经历了协同三元环过渡态,过渡态中一个芳环与卡宾平面几乎共平面,另一个芳环则与卡宾平面几乎正交。当其中一个芳环上有取代基时,则会出现两种过渡态结构(TS-1和TS-2)。这两种过渡态的能量不同,富电子芳环与卡宾共平面时过渡态能量更低,两个过渡态的能量差与相应取代基的Hammett常数(σp)呈线性相关(图4A)。

图4. 双芳基卡宾对硅氢键插入反应的过渡态
当使用手性磷酸双铑催化剂C1(催化剂螺环骨架上没有取代基,同样具有高对映选择性)进行计算时,发现硅氢键从金属卡宾Re面接近时过渡态TS-3能量最低(图4B)。由于卡宾两个芳环的电性差异导致其空间朝向不同,使得过渡态TS-5比TS-3的能量高5.6 kcal/mol。此外,由于催化剂的空间位阻,过渡态TS-4比过渡态TS-3的能量高2.2 kcal/mol。在能量最低的过渡态TS-3中,富电子芳环与卡宾的共平面程度(θ = 19.5˚)比在过渡态TS-4中更高(θ = 31.6˚)。由于电性与空间位阻的双重不利因素,过渡态TS-6的能量最高。这一计算结果表明在双芳基卡宾对硅氢键的插入反应中,手性催化剂C1识别和固定了过渡态的构象,而这个构象本质上是由于卡宾取代基的电性差异所产生。
总结
南开大学周其林院士、朱守非教授团队和加州大学洛杉矶分校Houk教授团队实现了一类由底物电性诱导的高对映选择性硅氢键插入反应。计算化学研究表明手性磷酸双铑催化剂能够精确地识别反应过渡态的构象,进而决定了反应的对映选择性。这种手性诱导模式不仅能够解决空间位阻相近的双芳基卡宾的不对称反应,同时也为碳正离子、自由基等活性中间体的不对称反应提供了新的手性控制策略。