杂双环八氢异吲哚骨架普遍存在于天然产物和药物中,因此,发展它们的高效合成方法具有重要意义。其中金属催化的环加成反应对底物的空间结构和电子性质要求较高,底物局限性大。而利用分子内呋喃与烯烃的Diels-Alder环加成反应尽管能够一步合成氧桥联的六氢异吲哚衍生物,但底物范围同样受限:活化基团(含卤素的呋喃环或含吸电子基团的烯烃)通常是反应所必需的;未活化底物的环加成反应可逆,即使是空间位阻较小的单取代末端烯烃也可发生逆Diels-Alder反应,导致原料剩余;未活化非末端烯烃的反应活性很差。更重要的是,未活化底物缺少官能团,难以与催化剂作用实现立体选择控制。
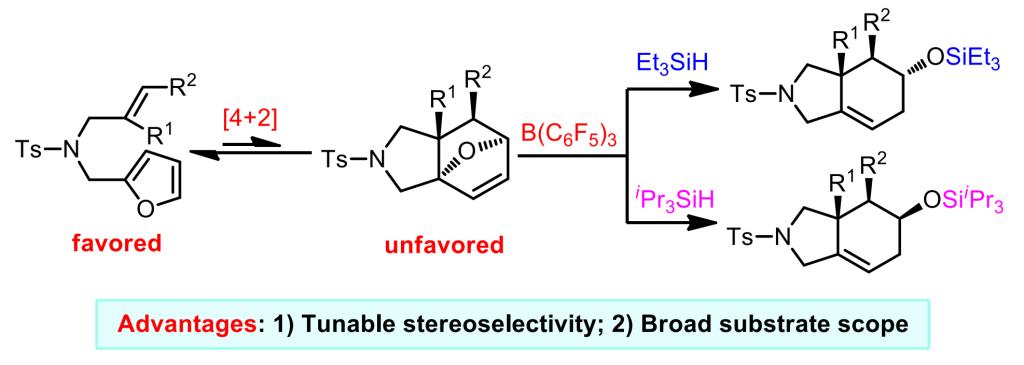
近期,王晓晨课题组报道了B(C6F5)3催化的N-烯丙基-N-糠酰胺的串联反应,涉及分子内呋喃Diels-Alder反应和醚键断裂的过程。通过不可逆的醚键断裂反应促使Diels-Alder反应平衡向产物移动,从而大大拓展了原Diels-Alder反应的底物适用范围,甚至可以兼容三烷基取代的烯烃。而且,通过调节硅烷取代基实现了产物相对构型控制,使用Et3SiH和iPr3SiH,可以获得两种不同的非对映异构体。对照实验和计算研究表明,硅烷基的空间位阻决定了反应途径以及产物的相对构型。该研究成果发表在J. Am. Chem. Soc.上,王晓晨课题组的博士毕业生刘志云和硕士生张鸣为该论文共同第一作者。该研究工作得到了国家自然科学基金委和南开大学的资助。
文章链接:https://pubs.acs.org/doi/abs/10.1021/jacs.9b11909