含氮芳环广泛存在于天然产物、药物分子、有机材料及配体中。通过选择性碳氢键官能团化的方式对含氮芳环进行后期修饰具有重要意义。在酸性和氧化条件下,自由基对含氮芳环的加成反应,即Minisci反应,提供了一种很高效地合成烷基取代的含氮芳环的方法。传统上的Minisci反应往往需要过量的氧化剂和酸以及很高的温度,这大大限制了底物的适用范围。随着光催化在有机合成中的快速发展,近几年来,有机化学家们报道了多种光催化下的Minisci反应,并且成功应用到药物的合成中。但非活化卤代烷烃作为烷基自由基的来源来实现Minisci反应却鲜有报道,这主要是由于非活化卤代烷烃的还原电位较低,很难被光催化剂还原产生烷基自由基。
由于硅溴键BDE值(96 kcal/mol)和碳溴键BDE值(69 kcal/mol)的差异,由硅基自由基攫取卤代烷烃的卤原子产生烷基自由基的过程很容易发生。受此启发,南开大学汪清民教授课题组实现了可见光催化下非活化卤代烷烃的Minisci C-H烷基化反应。这一成果近期发表在Chem. Sci.,并被选为封面文章(“牛郎织女鹊桥相会”)。

当期封面。图片来源:Chem. Sci.
该Minisci反应的条件温和,首次使用氧气作为氧化剂,这使得该反应具有良好的官能团兼容性和底物适用范围(图1)。
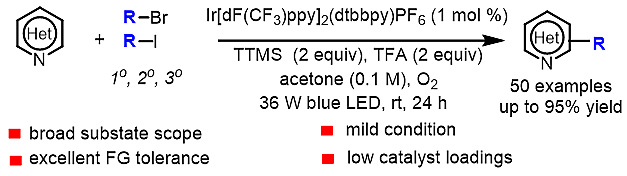
图1. 光催化非活化卤代烷烃的Minisci C-H烷基化反应
此方法提供了一种新颖的“后期官能团化”策略,可用于制备使用以往方法难以获得的复杂分子。为了考察该反应的实用性,作者对多种天然产物和药物进行了后期官能团化修饰。
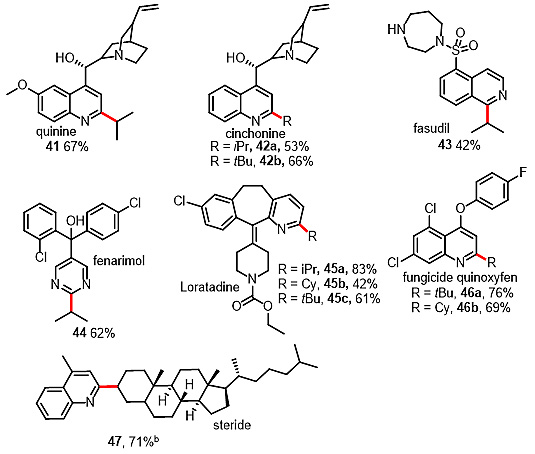
图2. 天然产物和药物的后期官能团化研究
实验及机理研究表明:在光照条件下,光催化剂被激发,同时体系中的烷基溴会产生微量的Br-离子,激发态的三价光催化剂将Br-离子氧化成溴自由基,同时得到二价态的光催化剂。溴自由基攫取硅烷的氢原子产生硅基自由基。由于硅溴键BDE值(96 kcal/mol)和碳溴键BDE值(69kcal/mol)的差异,硅基自由基攫取溴代烷烃的溴原子产生烷基自由基A。亲核性的烷基自由基A对含氮芳环加成得到反应中间体B。氧气氧化二价态的光催化剂以完成整个光催化的循环同时得到O2−.,O2−.攫取中间体B的氢原子得到最终产物。
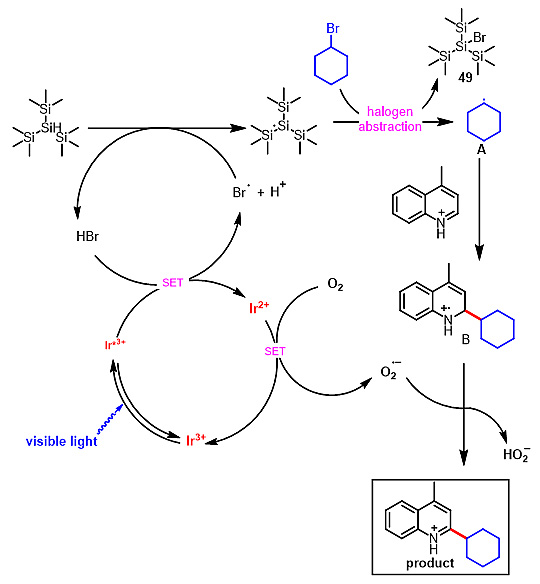
图3. 机理研究
该论文的第一作者是南开大学元素所的博士生董建洋,通讯作者是南开大学汪清民教授。上述研究工作得到了国家自然科学基金(21732002, 21672117)和天津市自然科学基金(16JCZDJC32400)的资助。
该论文作者为:Jianyang Dong, Xueli Lyu, Zhen Wang, Xiaochen Wang, Hongjian Song, Yuxiu Liu, Qingmin Wang.
原文链接:Visible-Light-Mediated Minisci C–H Alkylation of Heteroarenes with Unactivated Alkyl Halides Using O2 as an Oxidant. Chem. Sci., 2019, 10, 976-982, DOI: 10.1039/C8SC04892D.