自1928年Diels和Alder通过对苯醌与环戊二烯的二聚反应研究发现第一例Diels-Alder反应以来,苯醌由于其缺电子特性,常被用作环加成反应中的亲双烯体从而高效构建多取代六元环系。直到1965年Joseph Nathan等人在研究天然产物perezone时观察到在强路易斯酸促进下,对苯醌perezone可与分子内富电子烯烃发生非经典的[5+2]环加成反应,从而生成双环[3.2.1]辛烷结构。后续众多合成化学家如:Mamont、Büchi、Engler、Yamamura、Grieco、Green、Pettus以及四川大学的刘波教授等都对该反应开展了研究拓展。在仅有的一些合成例子中,这类对苯醌的[5+2]环加成反应的亲双烯体片段多局限于富电子烯烃,并且通常需要较为苛刻的条件(过量的强路易斯酸、长时间加热)。
近期,南开大学邓军课题组利用有机催化剂,通过氢键活化缺电子烯烃,实现了首例对苯醌与分子间缺电子烯烃的[5+2]环加成反应,并将该方法应用于曲霉酮A和B的不对称全合成中。
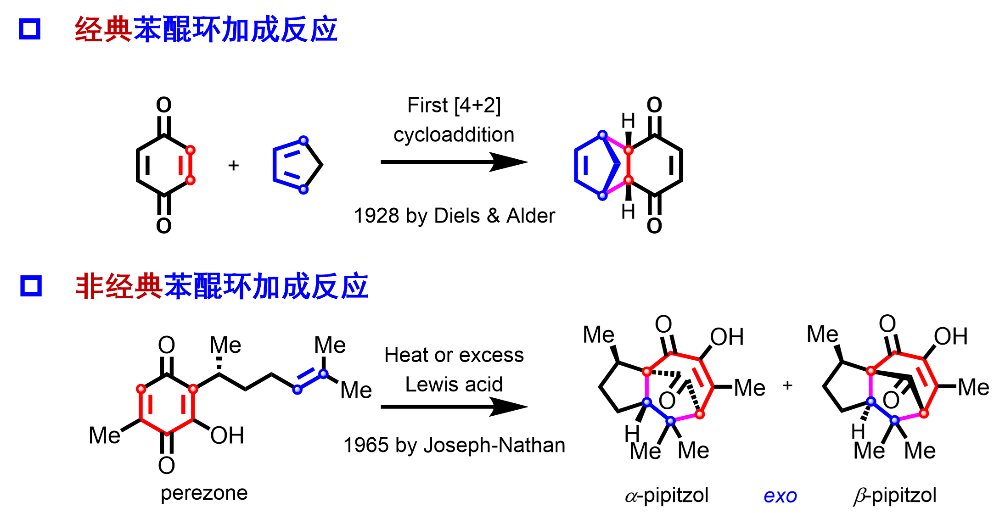
高度官能团化的双环[3,2,1]桥环结构作为诸多天然产物和药物分子的核心骨架,也因为其高氧化态和多元化的官能团,在化学合成上更具挑战性,从而受到诸多化学家的关注。曲霉酮A和B(asperones A和B)是由我国中国药科大杨明华、孔令义课题组从蜈蚣肠真菌中分离鉴定的两个具有双环[3,2,1]桥环结构的聚酮类天然产物,具有一定的抗炎活性,目前还没有相应的全合成报道。
南开大学邓军课题组目前一直致力于复杂天然产物的全合成研究,发展新颖的构建桥环的方法与策略。近日,该研究团队完成了Asperones A和B的首次不对称全合成。核心策略包括:(1)通过Diels-Alder串联逆Diels-Alder反应构建多取代苯酚;(2)不对称氰硅化以高对映选择性构建手性季碳中心;(3)利用奎宁类有机小分子催化剂完成核心的[5+2]环加成反应。
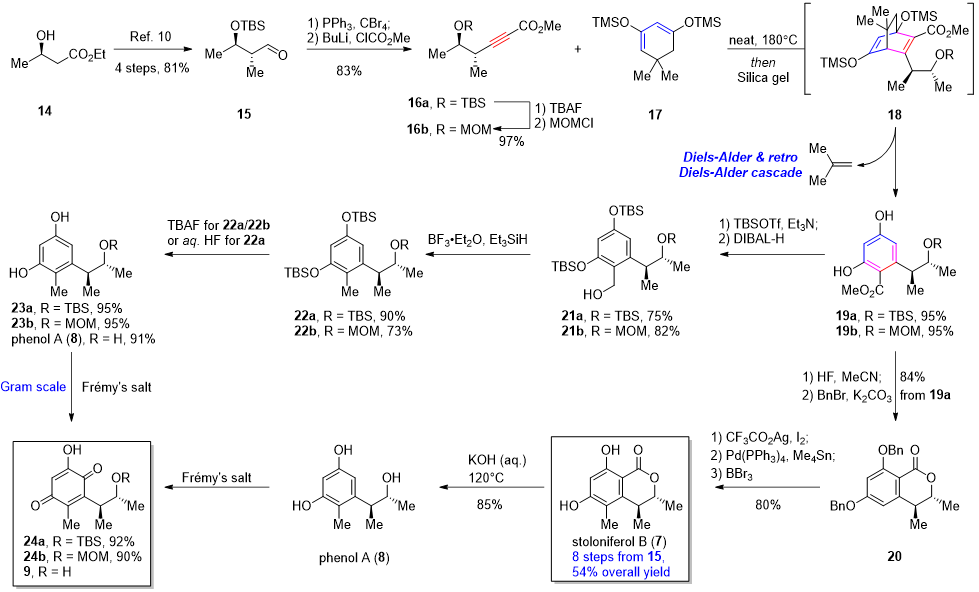
针对关键片段化合物9的合成,作者发展了两条路线。从手性底物14出发,经过Corey-Fuchs反应,随后通过Diels-Alder串联逆Diels-Alder反应构建二酚化合物19,随后分为两条路径。其一为通过官能团转化、还原构建甲基、氧化构建羟基对苯醌完成合成。另外也可以先完成天然产物stoloniferol B的合成,随后通过脱羧反应完成化合物9的合成。
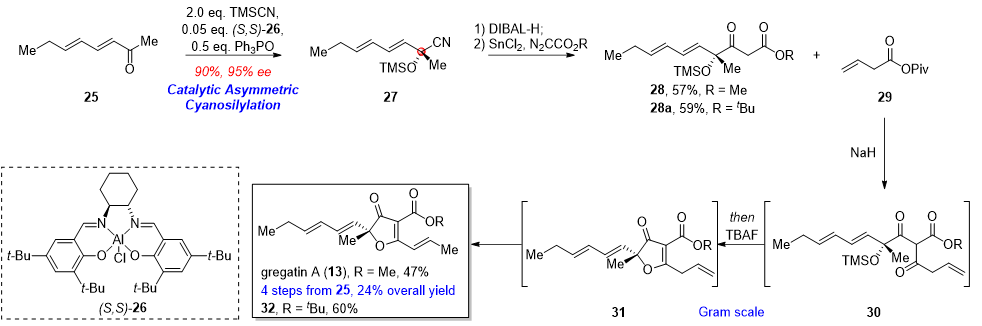
针对关键片段gregatin A的合成,作者利用周剑课题组开发的不对称氰硅化反应,高效构建季碳手性中心。随后通过Roskamp反应、脱保护串联关环,最终以4步24%总收率完成gregatin A的全合成。
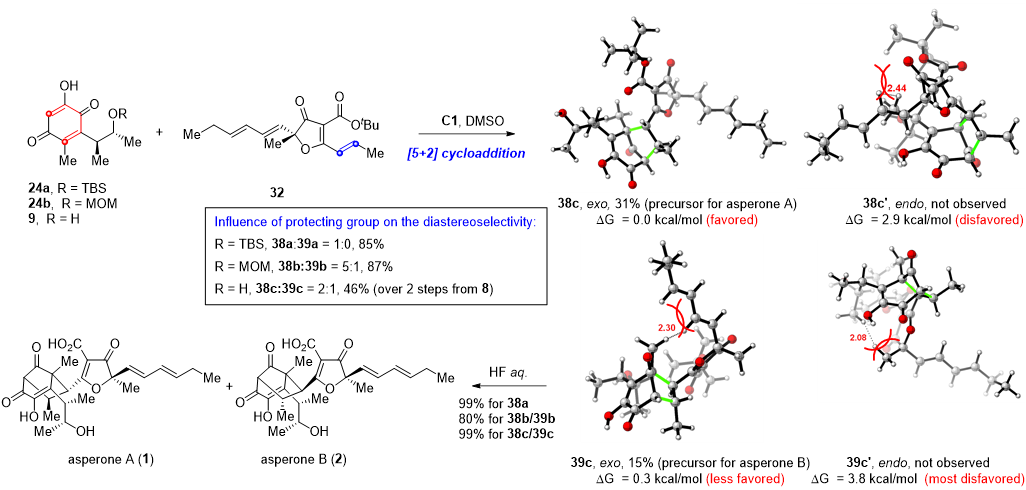
最后作者通过一系列条件筛选,利用奎宁胺类小分子催化剂,实现了首例羟基对苯醌与缺电子烯烃的分子间[5+2]环加成反应,以10步实现了Asperones A和B的首次不对称全合成,为未来双环[3,2,1]桥环结构的构建提供了新工具和思路。
论文的共同第一作者为南开大学博士生曲春雷与陈路,邓军研究员为通讯作者,该研究得到了国家基金委优秀青年基金、面上项目等项目的资助。
原文(扫描或长按二维码,识别后直达原文页面):

Asymmetric Total synthesis of Asperones A and B through Organocatalyzed Quinone [5 + 2] Cycloaddition
Chunlei Qu, Lu Chen, Peng Wang, Jingwei Zhang, Yiming Ding, Xianwen Long, Tingrong Zhang, Yaqiu Zhao, Jun Deng*
J. Am. Chem. Soc. 2025, DOI: 10.1021/jacs.4c16252