脉冲电子自旋共振中逐渐成为一门重要的生物物理技术,可以通过测量两个顺磁中心之间的距离分布,提供丰富的生物大分子结构变化和相互作用信息。目前常用的脉冲电子自旋共振PELDOR测定距离的实验主要有DEER、DQC和RIDME,这些可以统称为脉冲耦极电子自旋共振 (pulsed dipolar EPR, PD-EPR)。PD-EPR主要依赖于对修饰到生物大分子上的自旋-自旋对距离的测量,在复杂研究体系中,如何获取多种自旋-自旋对的距离信息是关键。相同类型的自旋-自旋对之间的距离在PD-EPR测量中常常难以分辨,因此如何在生物大分子上高效定点引入不同自旋标记物是发展PD-EPR生物应用的关键。
1,2-氨基硫醇作为一个功能单元可以发生不同于自由巯基的化学反应,醛类化合物和1,2-氨基硫醇的环化是一种有效的应用于蛋白质修饰的方法,但是很少有脂肪醛环化在蛋白质生物偶联中的报道。近日,南开大学苏循成团队发展了一种以脂肪醛基作为连接基团的新的定点自旋标记方法,并基于此开发了一种新的蛋白质正交自旋标记策略(图1)。该策略是一种将醛基环化和传统的巯基化学相结合的一锅法反应,蛋白中的1,2-氨基硫醇可以通过构建N端半胱氨酸(NCys)或通过基因密码子扩展技术获得所需的标记位点,利用带有醛基的自旋标签与蛋白质1,2-氨基硫醇(以NCys为例)部分环化,然后第二个自旋标记物与游离的蛋白质硫醇反应。与已有的正交标记策略相比,该策略具有高度的标记选择性和特异性,可以实现高效的定量转化,且避免了复杂的蛋白表达、标记和后处理过程。
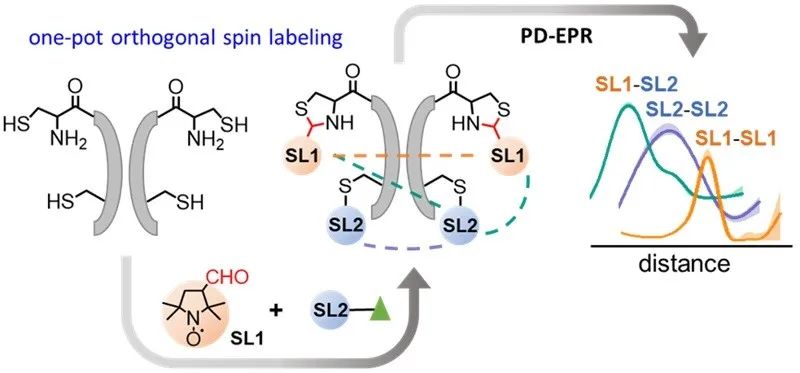
图1. 基于“醛基环化+巯基化学”的蛋白质正交自旋标记策略。图片来源:J. Am. Chem. Soc.
作者设计了一系列NO自旋标记物并测定了该醛基标签与NCys的环化反应动力学(图2)。结果表明只有T1-T3能与NCys发生环化反应。T1在温和的反应条件下(近中性的水溶液)对NCys实现了高选择性且快速和完全的标记。这与普遍认为的醛基与NCys环化条件,即酸性条件下大过量的醛也难以实现完全标记,有很大差异。水解动力学实验和半胱氨酸竞争实验结果表明,生成的噻唑烷产物在中性环境或存在大量小分子1,2-氨基硫醇的环境中可以保持较长时间的稳定性,保证了T1在复杂生物体系的EPR谱研究中的实用价值。

图2. 醛基自旋标签与NCys的反应路线示意图以及本工作中的其他自由基和金属自旋标记物。图片来源:J. Am. Chem. Soc.
作者进一步通过带有NCys和内部半胱氨酸的模式蛋白,建立了基于“醛基环化+巯基化学”的蛋白质正交标记策略(图3)。模式蛋白中1,2-氨基硫醇部分首先与醛基自旋标签进行环化反应,然后在不进行任何处理的情况下评估了通过巯基化学安装第二个自旋标签的可行性,包括氮氧自由基 (NO)、三甲基自由基 (TAM) 或顺磁金属配合物标记物如Mn(II) 和Gd(III) 标签。质谱表征结果表明,在存在内部半胱氨酸残基的情况下,环化反应对1,2-氨基硫醇仍然具有高度选择性,该策略可以通过伪级联反应实现正交自旋标记(图3a)。作者还建立了T1(NO标签)-CT02MA(TAM标签) 的正交PD-EPR测量方法,通过调整激发和观测脉冲,进行模式蛋白二聚体中T1-T1、T1-CT02MA的DEER测量和CT02MA-CT02MA的DQC测量,实现了对不同自旋对之间距离信息的分别获取(图3b)。

图3. 用于PD-EPR距离测量的蛋白质正交自旋标记。(a) “醛基环化+巯基化学”的蛋白质正交标记路线及质谱表征。(b) 通过T1-CT02MA标记的模式蛋白二聚体的正交PD-EPR测量策略及结果。图片来源:J. Am. Chem. Soc.
最后,作者通过建立的T1-CT02MA正交标记方法描述了大肠杆菌伴侣蛋白触发因子(TF)在缓冲液和大肠杆菌细胞裂解液中的二聚行为及构象变化(图4),证明了该正交自旋标记策略的应用潜力。从不同类型的自旋-自旋对中获得的多组距离信息表明,TF在溶液中以二聚体的形式存在,在细胞裂解液中几乎以单体的形式存在,且在单体和二聚体转化过程中TF的N端与359位残基间没有发生距离变化,这一发现打破了TF主要以二聚体形式存在的传统认知,后续工作仍需要阐明TF的具体工作机制。

图4. 通过T1-CT02MA正交自旋标记检测缓冲液和细胞裂解液中TF的二聚化。图片来源:J. Am. Chem. Soc.
综上,本文提出的正交自旋标记方法为复杂系统中多种自旋标签的引入提供了一种简便高效的标记策略,可以通过一锅法实现对单个蛋白样品正交标记,借助不同PD-EPR方法进行距离测定,实现多个蛋白质距离约束的高准确性和高精度测定。这一成果近期发表在Journal of the American Chemical Society 上,南开大学的博士研究生孟维涵和张兴为共同第一作者,南开大学化学学院苏循成教授和杨茵研究员为共同通讯作者。本工作得到了天津医科大学刘阳平团队提供了本研究中的TAM自由基并得到了以色列威兹曼科学研究院Daniella Goldfarb教授指导。本工作所有EPR实验均在南开大学元素有机化学国家重点实验室Q-波段脉冲电子自旋共振谱仪上完成。本工作得到了国家自然科学基金委地区合作项目和重大研究计划的支持。
原文(扫描或长按二维码,识别后直达原文页面):

Efficient Orthogonal Spin Labeling of Proteins via Aldehyde Cyclization for Pulsed Dipolar EPR Distance Measurements
Wei-Han Meng,⊥ Xing Zhang,⊥ Bin-Bin Pan, Xiaoli Tan, Jia-Long Zhao, Yangping Liu, Yin Yang,* Daniella Goldfarb, Xun-Cheng Su*
J. Am. Chem. Soc., 2024, DOI: 10.1021/jacs.4c09139