手性2-甲基-3-戊烯-1,5-二醇包括其氧化和还原的衍生物,均含有多个连续的手性中心,是许多重要天然产物的关键结构单元,也是合成聚酮类天然产物的重要中间体(图1)。然而,当前构建该类核心结构的方法往往需要多步转化,才能实现产物的对映选择性和非对映选择性的控制,导致合成效率较低。因此,开发高效高选择性的催化不对称合成方法,实现手性2-甲基-3-戊烯-1,5-二醇的一步合成具有重要意义。
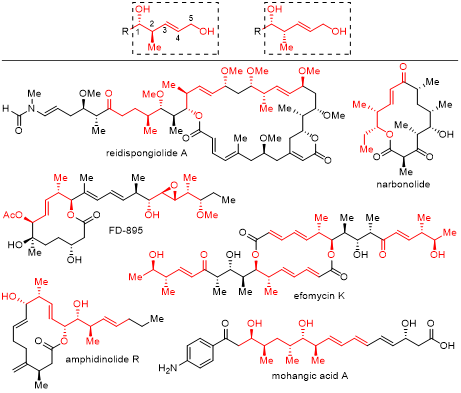
图1. 含有手性2-甲基-3-戊烯-1,5-二醇结构单元的天然产物。图片来源:J. Am. Chem. Soc.
近日,南开大学肖力军课题组报道了首例镍催化1,3-二烯与醛的不对称硼化偶联反应,成功实现了具有高附加值的高烯丙醇的立体发散性合成(图2)。该反应具有优异的非对映选择性和对映选择性,为手性2-甲基-3-戊烯-1,5-二醇的一步合成提供了高效方法。反应的非对映选择性可通过二烯底物的(Z)/(E)构型控制。手性螺环膦-噁唑啉配体的使用是实现该不对称合成的关键。
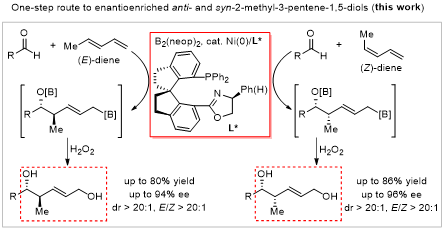
图2. 镍催化1,3-二烯和醛的不对称硼化偶联反应。图片来源:J. Am. Chem. Soc.
通过系统的反应条件优化,作者发现了手性螺环膦-噁唑啉/镍络合物(Ni/L10)是催化1,3-二烯与醛硼化偶联反应的有效催化剂,并成功实现了(E)-1,3-二烯与醛的不对称硼化偶联反应,以中等及以上的收率和优异的非对映选择性和对映选择性得到anti构型的产物(图3)。

图3. 镍催化 (E)-1,3-二烯和醛的不对称硼化偶联反应。图片来源:J. Am. Chem. Soc.
随后,作者发现在硼化偶联反应中如果使用(Z)-二烯可实现非对映选择性的逆转,形成syn构型的产物。例如,(Z)-1,3-戊二烯与4-甲氧基苯甲醛在Ni/L10的作用下,能以81%产率和82% ee的对映选择性获得产物5a。作者发现将配体L10更换为L7可以将反应的对映体选择性提高至90% ee。随后,作者以Ni/L7为催化剂研究了不同醛类与(Z)-1,3-二烯的反应,得到了具有高对映选择性的syn构型产物(图4)。

图4. 镍催化(Z)-1,3-二烯和醛的不对称硼化偶联反应。图片来源:J. Am. Chem. Soc.
上述合成策略的另外一个亮点是反应得到的手性烯丙基硼中间体还可以进行其他转化(图5)。例如,4-甲氧基苯甲醛与(E)-1,3-戊二烯进行硼化偶联反应后,生成的手性烯丙基硼中间体可以与溴苯进行Suzuki-Miyaura偶联反应,并以52%产率和93% ee的对映选择性得烯丙苯衍生物6。此外,中间体烯丙基硼还能够与苯甲醛反应生成具有高对映选择性(94% ee)的高丙烯醇7。
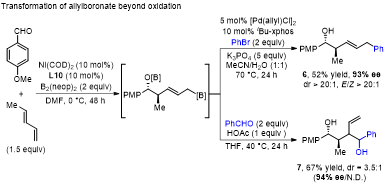
图5. 手性烯丙基硼的转化。图片来源:J. Am. Chem. Soc.
随后,作者根据文献和实验结果,建议了反应的机理(图6)。首先,手性镍催化剂介导醛与(E)-1,3-二烯或(Z)-1,3-二烯发生氧化环金属化过程,分别形成中间体8和9。中间体8(中间体9)立体化学构型是由配体(L10或L7)决定。另外,反应的非对映选择性由环镍中间体的优势构型控制:醛的苯基和(E)-二烯的甲基取代基之间反式构型避免了环镍中间体8中不利的1,2-相互作用;醛的苯基和(Z)-二烯的甲基取代基之间的顺式构型避免了烯丙基和L7配体的噁唑啉之间不利的相互作用。即两种取向的结果均是减少配体(L10或L7)与二烯上取代基之间的空间排斥,提高产物的立体选择性。
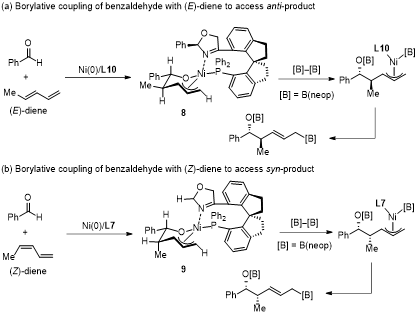
图6. 可能的反应机理和手性诱导模型。图片来源:J. Am. Chem. Soc.
综上,作者开发了首例镍催化1,3-二烯与醛的不对称硼化偶联反应,实现了手性2-烷基-3-戊烯-1,5-二醇的立体发散性合成。该方法能够以高的非对映选择性合成anti和syn构型的产物。手性螺环膦-噁唑啉配体L7和L10是实现不对称控制的关键。反应为相关高附加值化合物和天然产物高效合成提供了一种新方法。
该研究工作近期发表在J. Am. Chem. Soc.上,文章通讯作者为南开大学肖力军研究员,第一作者为南开大学博士研究生马锦涛。该项工作得到了国家自然科学基金和科技部重点研发计划的支持。
论文信息:
Diastereodivergent and Enantioselective Synthesis of Homoallylic Alcohols via Nickel-Catalyzed Borylative Coupling of 1,3-Dienes with Aldehydes
Jin-Tao Ma, Tianze Zhang, Bo-Ying Yao, Li-Jun Xiao*, Qi-Lin Zhou
https://pubs.acs.org/doi/10.1021/jacs.3c07697