可见光诱导SO2保留的自由基Smiles重排:高效构建烷基砜衍生物
砜基、磺酰胺和磺酰氟广泛存在于各种天然产物、农用化学品和药物中,如抗前列腺癌与抗炎药比卡鲁胺和阿普斯特、杀虫剂氟虫双酰胺等(Scheme 1A)。亚磺酸盐是合成含有磺酰基衍生物的通用中间体,在过去的几十年中,亚磺酸盐的合成备受关注,离子型Smiles重排反应是合成亚磺酸盐的有效方法。自从1970年代,Speckamp等课题组开发了涉及自由基化学的Smiles重排反应,通过该策略,可合成复杂的N-杂环和(杂)芳基化合物以及实现烯烃和炔烃的双官能团化反应。其中代表性的研究成果如下,Nevado课题组报道了通过过渡金属催化的自由基Smiles重排反应合成了复杂的N-杂环化合物,Stephenson课题组利用可见光介导的自由基Smiles重排合成了一系列结构复杂的(杂)芳基化合物(Scheme 1B-1)。Stephenson和朱晨课题组通过光氧化还原催化自由基Smiles重排分别实现了非活化烯烃的双官能化反应(Scheme 1B-2)。但这些反应会释放SO
2
,值得注意的是,对于磺酰基的保留,是一种更原子经济性的策略。
最近,南开大学汪清民课题组报道了一种使用CF3SO2Na或芳基亚磺酸钠作为非活化烯烃双官能团化反应的自由基前体,通过可见光介导SO2保留的自由基Smiles重排反应,合成一系列脂肪亚磺酸盐,并一锅法转化成结构多样的含砜衍生物(Scheme 1C)。
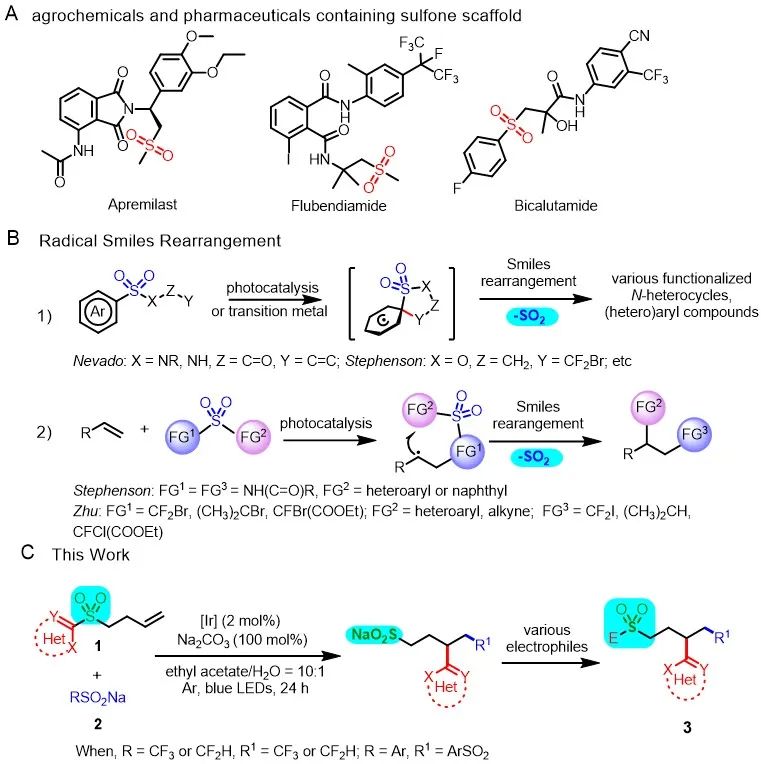
图1. 研究背景和工作总结(来源:Green Chem.)
首先,作者以1a作为模板底物,与CF3SO2Na(2a)反应,进行了相关反应条件的筛选(Table 1)。当以[Ir(dF(CF3)ppy)2(dtbbpy)]PF6(2 mol%)作为光催化剂,Na2CO3(1 equiv)作碱,EA/H2O = 10:1(2 mL)作为混合溶剂,在30 W的440 nm紫外灯照射下室温反应24 h后,再一锅法与苄溴反应,即可以75%的收率获得产物3a。
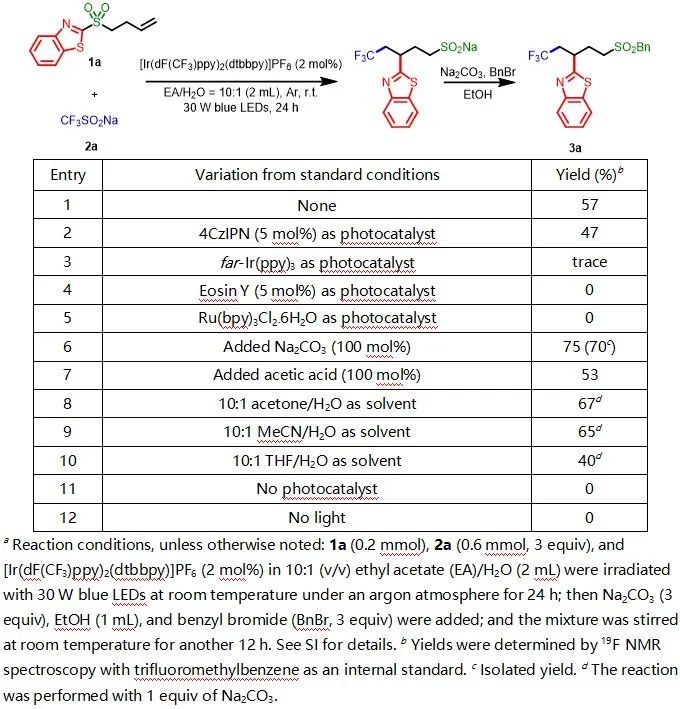
表1. 反应条件的筛选(来源:Green Chem.)
筛选出了反应的最优条件以后,作者首先对丁烯基杂芳基砜1的底物适用性进行了探索(Scheme 2)。首先,当底物1中的杂芳基为具有不同电性取代的苯并噻唑时,均可与CF
3
SO
2
Na顺利反应,以中等的收率(51%-78%)得到产物3a-3g。当底物1中的杂芳基为苯并噁唑、嘧啶、取代噻唑时,也以中等收率(60%-75%)获得相应的产物3h-3l。此外,CF
2
HSO
2
Na(2b)作为自由基前体,也可获得相应的产物3m(70%)和3n(57%)。然而,当底物中芳基为含有缺电子4-F或富电子4-OMe取代的苯环时,反应不能进行。
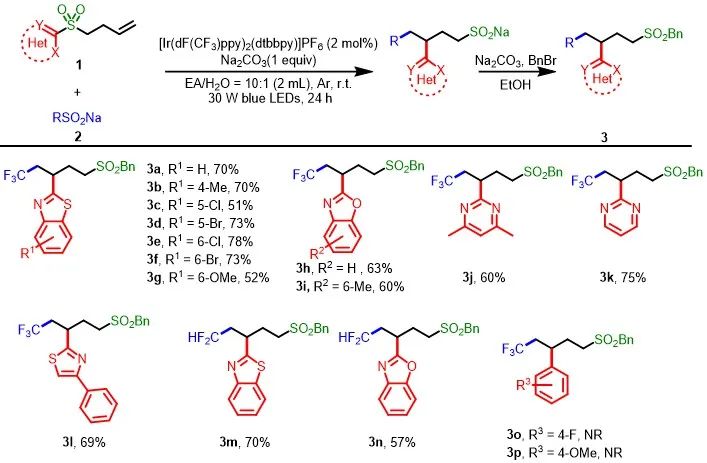
图2. 丁烯基杂芳基砜的底物适用范围(来源:Green Chem.)
随后,作者发现,当以芳基亚磺酸钠4a作为自由基前体,CH
3
CN/H
2
O = 5:1作为溶剂时,能以收率81%获得5a。作者认为水作为共溶剂是该反应的关键,水可以溶解芳基亚磺酸钠。紧接着,作者对亚磺酸钠4的底物范围进行了探索(Scheme 3)。首先,当底物4为带有不同电性取代基的芳基亚磺酸钠时,均可获得相应的产物5a-5h,收率为27-71%。其次,当底物4中的R为萘基、苯并呋喃基、乙基时,可以收率为43-65%获得相应的产物5i-5l。此外,当底物1中的杂芳基为含有取代基的苯并噻唑、苯并噁唑、嘧啶或噻唑时,也均与体系兼容,获得相应的产物5m-5p,收率为38-59%。此外,在3 mmol的规模下,1a与4a反应,可获得71%收率的产物5a,收率略有下降。
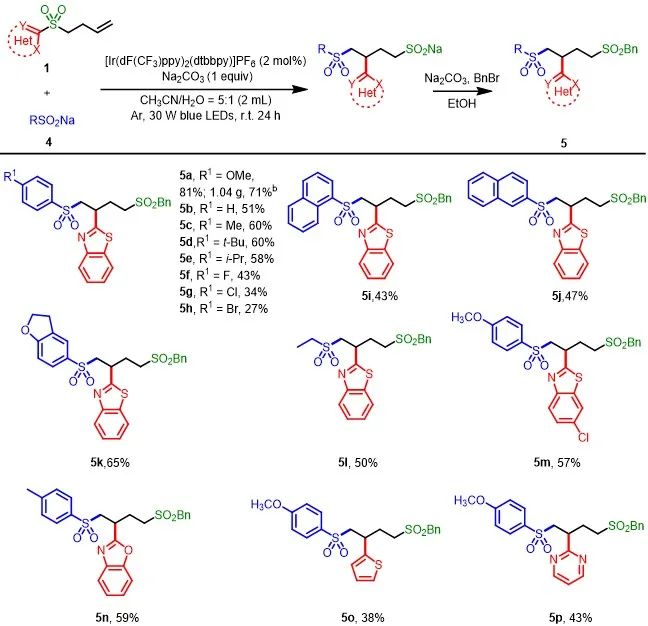
图3. 亚磺酸盐的底物适用范围(来源:Green Chem.)
为了证明该反应的实用性,作者以1a作为底物,进行了多种一锅法转化反应(Scheme 4)。首先,各种亲电试剂均可与中间体烷基亚磺酸钠顺利反应,获得相应的烷基砜衍生物6a-6f,收率为60-75%。其次,利用中间体烷基亚磺酸钠分别与NFSI和羟胺磺酸反应,能以中等收率(47%-60%)得到杂原子引入的产物6g-6h。
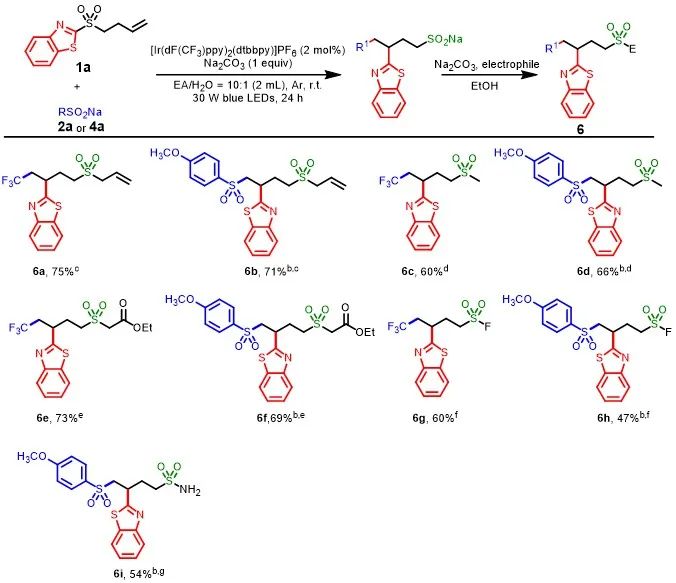
图4. 亚磺酸盐的衍生化(来源:Green Chem.)
为了进一步了解反应重排过程中形成环状过渡态的范围,作者选择了具有不同长度烷基链和取代乙烯基单元的底物,对反应进行了探索(Scheme 5)。当n为1或2时,无论R
1
是甲基还是氢,均可顺利反应,获得相应的产物6j-6n,收率为49-74%。然而,当n为0、3或4时,反应不能进行(如6o-6q)。上述实验结果表明,对于自由基Smiles重排,五元和六元环过渡态是可以进行的,而四元、七元和八元环过渡态是不合适的。
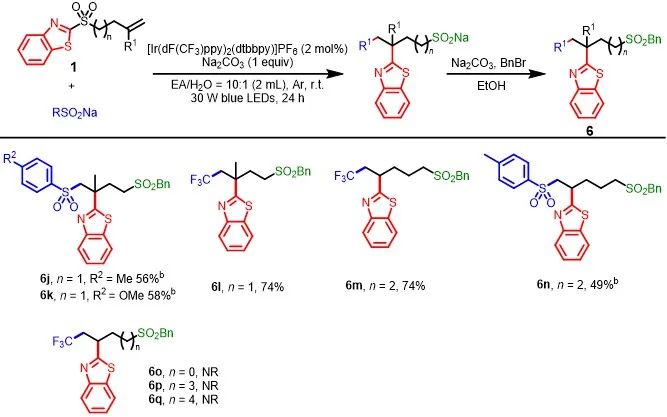
图5. 不同烯烃的底物范围(来源:Green Chem.)
随后,作者对该反应的机理进行了探索(Scheme 6)。首先,在1a与2a的模板反应体系中加入3当量的自由基抑制剂TEMPO或BHT时,反应受到抑制,同时通过高分辨质谱捕获到自由基加成产物3ab和3ac的生成,从而表明三氟甲基自由基可迅速与非活化烯烃反应,生成新的烷基自由基中间体(Scheme 6A)。当在1a与4a的标准反应体系中加入3当量的BHT时,5a的形成完全受到抑制(Scheme 6B)。上述结果表明,该反应是以自由基的过程进行的。此外,当使用1e、1o与4a进行混合反应时,获得产物3e(47%)和6b(56%),从而表明反应涉及分子内的自由基Smiles重排过程(Scheme 6C)。
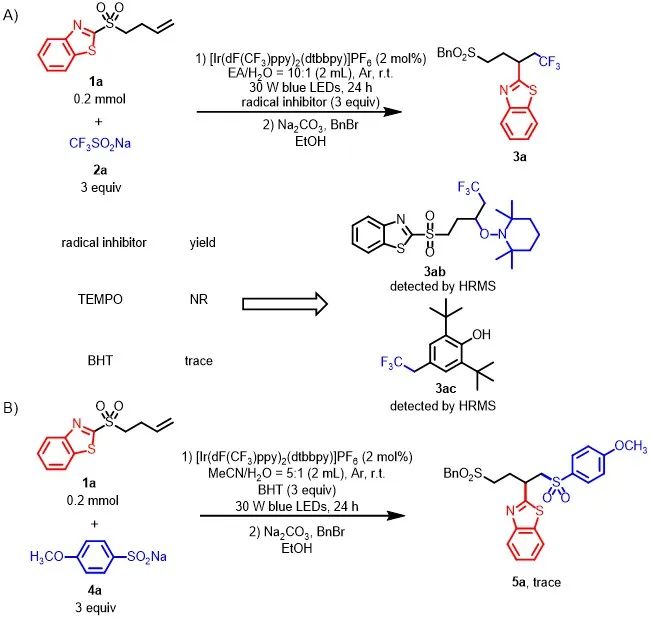
表6. 机理实验研究(来源:Green Chem.)
根据实验结果,作者提出了该反应的可能机理(Scheme 7)。首先,[Ir(dF(CF
3
)ppy)
2
(dtbbpy)]PF
6
在440 nm的光照下跃迁到激发态。激发态的光催化剂是一种强氧化剂,与CF
3
SO
2
Na或ArSO
2
Na 经单电子转移,生成三氟甲基或磺酰基自由基和Ir
II
。随后,该自由基可与烯烃1反应生成新的烷基自由基中间体(I),杂芳基立即捕获中间体I,再经Smiles重排,从而生成中间体III。最后,中间体III可与还原性的光催化剂Ir
II
发生单电子转移反应生成目标产物IV,并再生Ir
III
配合物,从而完成催化循环。
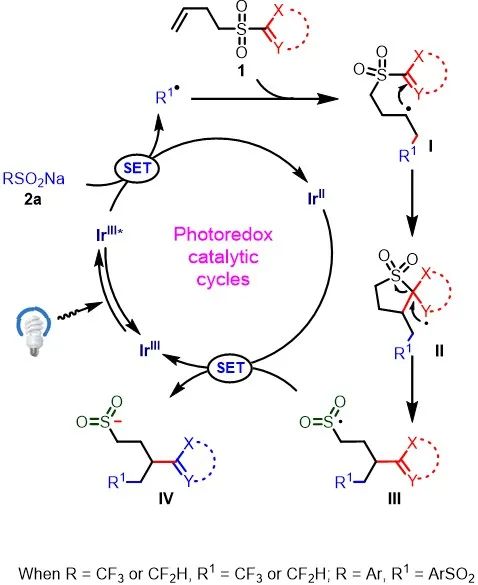
图7. 可能的反应机理(来源:Green Chem.)
作者开发了一种温和、高效且原子经济性高可见光诱导SO
2
保留的自由基Smiles重排反应,从而合成了一系列烷基亚磺酸盐中间体,并一锅法转化为具有极高应用价值的结构多样性的有机硫化合物。同时,该策略具有良好的官能团兼容性,并可用于一些具有杂芳基烷基砜骨架新药的研发。
本篇工作通讯作者为南开大学的宋红建副研究员、刘玉秀副教授和汪清民教授。南开大学硕士研究生曹云鹏为该论文的第一作者,王欣谋博士对该工作给予了悉心指导。上述研究工作得到了国家自然科学基金(Nos. 21732002、22077071)和南开大学有机新物质创造前沿科学中心(No. 63181206)的资助。
原文(扫描或长按二维码,识别后直达原文页面):
