芳基伯胺是药物、农药、配体和天然产物中最为关键的有机结构单元之一。氨气(NH3)作为一种理想的氮源,具有高原子经济性的优势。传统方法通常使用过渡金属催化的C−N偶联反应,如Buchwald−Hartwig和Ullmann−Ma胺化反应等。随着有机合成化学的不断发展,光化学等新的合成技术为芳基伯胺的合成方法提供了更多选择。但开发一种能够快速获得多样化芳基伯胺的通用方法仍然是迫切且必要的。近年来,电化学为有机合成带来了机遇和发展,它不仅提高了反应的效率和选择性,而且使反应能够在更温和的条件下进行,减少了环境污染和能源消耗。由于这种策略的优越性,在C-N耦合中也得到了广泛的应用。例如,Baran组、Mei组和其他小组分别通过C-N偶联实现了芳基卤化物的电化学胺化。然而,氮源主要来自于伯胺和仲胺,生成相应的仲胺或叔胺产物(图1A)。相比之下,由于芳基伯胺的氧化电位较低,与仲胺或叔胺相比更容易被氧化(图1A),因而芳基卤化物与NH3通过电化学C-N偶联直接合成芳基伯胺目前仍然难以实现。因此,开发一种在温和反应条件下合成芳基伯胺的方法仍然是亟待解决且极具挑战性的。
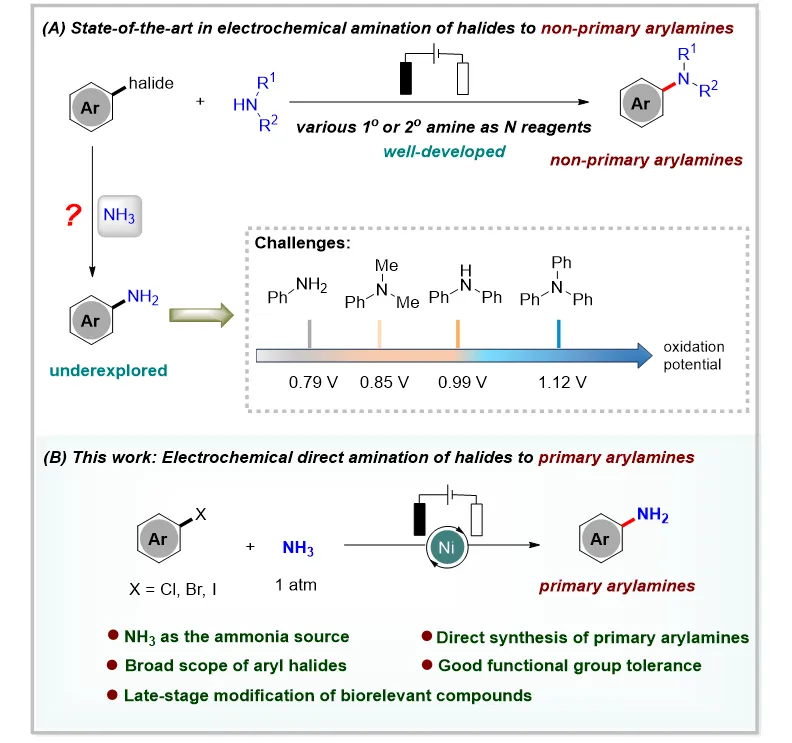
图1. 电化学芳基卤化物胺化策略
南开大学化学学院元素有机化学全国重点实验室仇友爱课题组聚焦于有机电合成化学及资源小分子高效转化(Acc. Chem. Res. 2025, 58, 113-129)。近日,仇友爱课题组报道了电化学条件下芳基卤化物与NH3胺化反应合成芳基伯胺(图1B)。该工作具有以下特点:a) 直接合成各种芳基伯胺衍生物;b) 使用弱亲核试剂NH3作为氨源,具有高原子经济性;c) 实现了各种芳基卤化物的高选择性胺化;d) 有良好的官能团耐受性和敏感基团兼容性;e) 成功实现了克级规模实验和药物活性分子修饰,表现出潜在的应用前景。
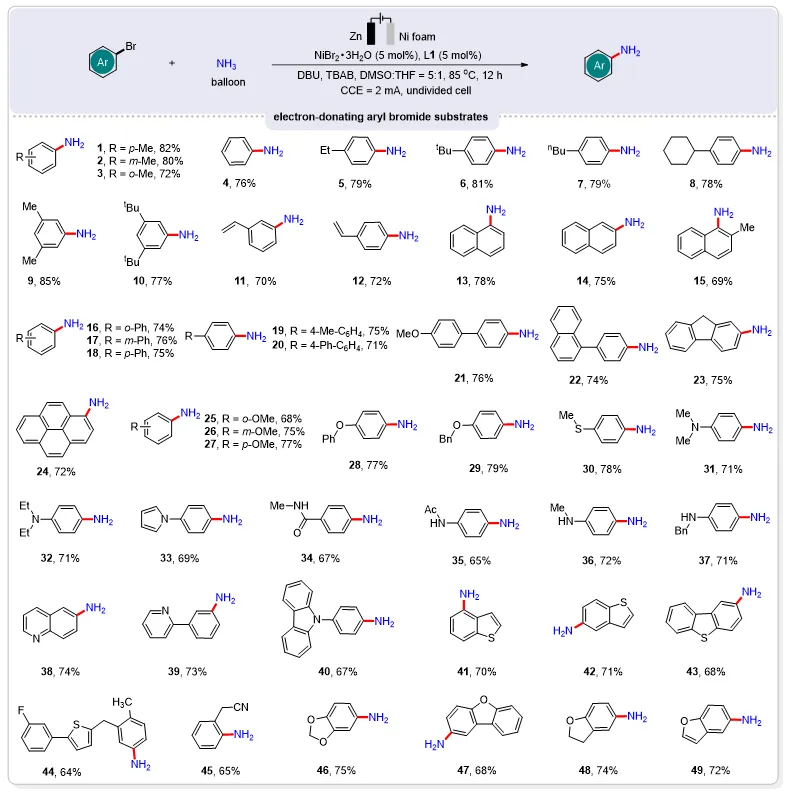
图2. 带有给电子基团的芳基溴化物底物普适性研究
经过系统的反应条件优化,研究团队最终确立了最优反应条件:5 mol%的NiBr2·3H2O、5 mol%的Bipyridine、DBU和TBAB作为催化体系,在DMSO/THF(5:1)混合溶剂中,以Zn为阳极、Ni泡沫为阴极,在85 °C下以2 mA的恒定电流电解12小时,得到目标产物对甲苯胺的产率为82%。
该方法对多种芳基卤化物表现出良好的官能团耐受性(图2),最初,各种各样的弱供电子芳基溴化物,包括甲基、乙基、叔丁基、正丁基、环己基和乙烯基,无论它们在芳香环上的位置如何,都很容易被容纳,并在标准条件下以优异的收率得到目标产物。此外,萘环和多环取代芳香族化合物的伯胺产物也以良好的收率获得。然后,对于强供电子基团,如甲氧基、氧苄基等,以良好的产率获得对应的目标产物。值得注意的是,含仲胺基的芳基溴化物顺利转化为芳基伯胺产物,没有检测到任何胺化的副产物,仲胺基保持完好。此外,各种杂环的芳基溴化物,包括6-溴喹啉、2-(3-溴苯基)吡啶、9-(4-溴苯基)-9H-咔唑、4-溴苯并噻吩、5-溴苯并菲、2-溴二苯并噻吩烯、2-对2,3-二氢苯并呋喃和5-溴苯并呋喃等,都成功地进行了高反应性的电化学转化,以良好的收率得到芳基伯胺产物。
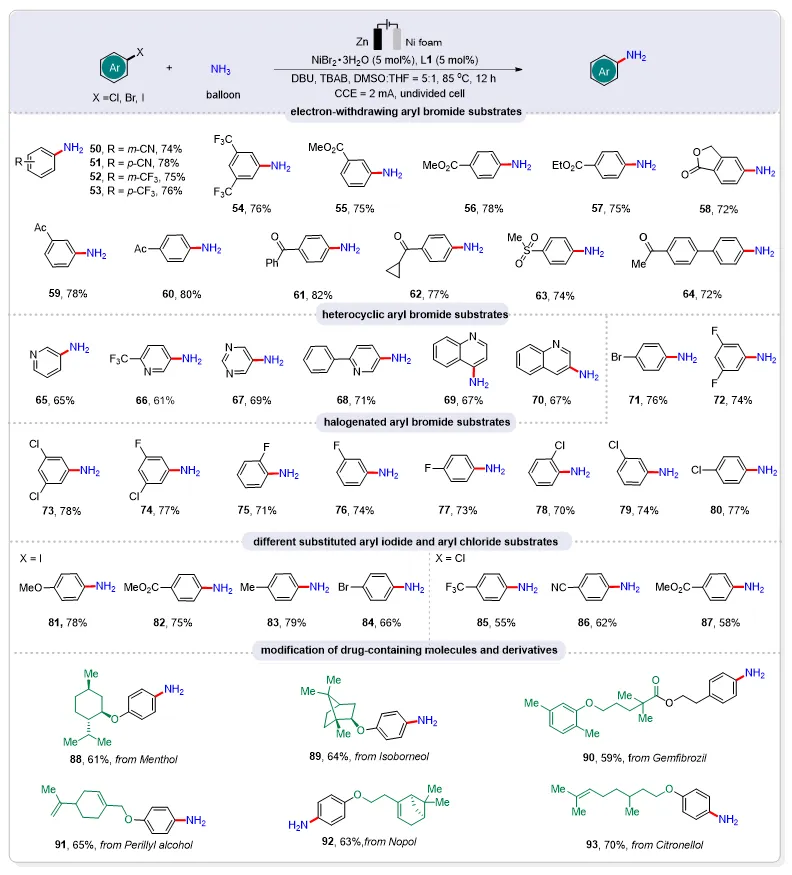
图3. 带拉电子基团的芳基溴化物、氮杂环溴化物、多卤取代的芳基以及后修饰的天然产物的普适性研究
通过系统考察结构复杂且具有高反应性官能团的芳基卤化物底物范围,成功实现了伯芳胺的高效合成,充分证明了该策略的普适性(图3)。实验结果表明,包括氰基、三氟甲基、酯基等在内的各类吸电子基团均能良好兼容该反应体系。对于吡啶、嘧啶和喹啉等含氮杂环溴化物,在NH3氛围下仍能高效反应,以优良收率获得目标芳基伯胺产物。此外,研究还发现多卤代芳烃(如二取代和多取代芳基卤化物)均可有效参与该转化过程。值得关注的是,在所有案例中均仅生成单一的单伯芳胺产物,这可能是由于C-F和C-Cl键的键能显著高于C-Br键所致。以1,4-二溴苯为例,反应选择性保留一个溴原子而仅使另一个溴原子发生胺化,未检测到对苯二胺副产物的生成。基于上述发现,作者进一步拓展研究了碘苯和氯苯衍生物的适用范围。实验数据表明,碘代芳烃的胺化反应几乎不受官能团类型影响,而氯代芳烃则仅适用于带有吸电子基团的底物。为验证本方法的实际应用价值,他们成功将其应用于多个药物分子的后期修饰。例如,薄荷醇、异冰片、吉非贝齐、紫苏醇、诺泊醇和香茅醇等具有生物活性的化合物和药物分子均可与NH3高效偶联,顺利获得相应的芳基伯胺衍生物。这些结果表明,通过这种简便高效的芳基卤化物氨气还原胺化策略,可直接构建未来药物研发和天然产物合成所需的基础骨架,展现出潜在的应用前景。
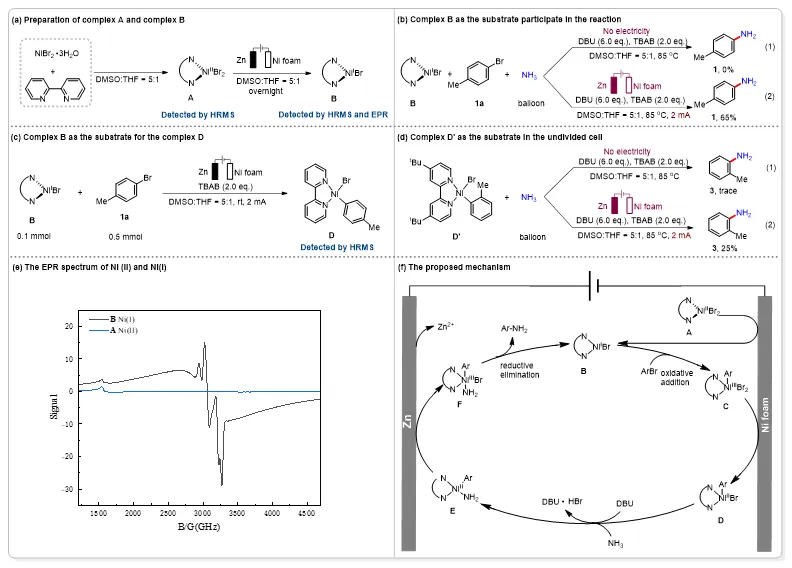
图4. 机理验证实验以及可能机理
为了深入探究该反应的机理,作者开展了一系列机理验证实验(图4)。首先,NiBr2·3H2O与联吡啶(bpy)配位,形成Ni(II)络合物A。随后,通过电化学还原,该络合物被转化为Ni(I)物种B,其结构通过高分辨质谱(HRMS)和电子顺磁共振(EPR)分析得到确认(图4a和4e)。为了验证Ni(I)物种B在催化循环中的作用,他们以4-溴甲苯为模型底物,分别在通电和不通电条件下进行对照实验。结果显示,仅在施加电流时才能检测到目标产物对甲苯胺(图4b-(2)),而无电流条件下则无反应发生(图4b-(1)),这表明 Ni(I)配合物B可能是催化循环启动的关键。进一步在无NH3和无碱(DBU)的条件下,尝试捕获可能的反应中间体D。实验证实,Ni(I)配合物B可与芳基卤化物发生氧化加成,生成Ni(III)中间体C,随后经电还原转化为Ni(II)中间体D(图4c)。为了更清晰地阐明催化循环,作者通过使用4,4'-二叔丁基-2,2'-联吡啶(dtbpy)和等摩尔量的Ni(0)与2-溴甲苯反应,成功分离并表征了稳定的Ni(II)中间体D'。随后,他们以D'为底物,在NH3氛围下进行反应。实验发现,在无电条件下,D'无法转化为目标芳基伯胺(图4d-(1));而施加电流后,可检测到25%的邻甲基伯芳胺生成(图4d-(2))。这一结果证实,Ni(II)中间体D在整个催化循环中不可或缺。为了验证阳极氧化过程,作者采用分隔电解池实验,以D'为底物,在阳极池中成功检测到19%的芳伯胺产物。这一结果表明,阳极可能发生Ni(II)物种E氧化为Ni(III)物种F的过程。
根据机理研究,作者提出了可能的催化循环机制(图4f)。首先,Ni(II)物种A在阴极发生还原,生成活性Ni(I)中间体B。随后,B与芳基卤化物发生氧化加成反应,形成Ni(III)中间体C。该中间体C经阴极进一步还原,转化为关键的Ni(II)中间体D。在DBU碱和NH3氛围作用下,D可能通过阳极氧化过程转化为Ni(III)中间体F。最终,F经还原消除反应生成目标芳基伯胺产物,同时再生Ni(I)中间体B,完成催化循环。这一机制不仅与已有文献报道相符,也得到了系统的电化学研究和中间体捕获实验的有力支持。
最后,为验证该方法的实用性,作者进行了克级规模实验,在简易的双颈烧瓶反应体系中,以60%的收率成功获得目标产物79,展现了该策略在合成应用中的潜力。
小结
仇友爱团队开发了一种高效的电催化体系,成功实现了芳基卤化物与氨气的直接胺化反应,为芳基伯胺的合成提供了一种绿色环保的新方法。该工作得到了科技部重点研发专项、国家自然科学基金委、中国博士后科学基金会,中央高校基本科研业务费及南开大学有机新物质创造前沿科学中心专项资金的支持。相关成果发表在Angewandte Chemie International Edition 上。南开大学化学学院仇友爱研究员为通讯作者,刘耀文博士为文章的第一作者。
原文:

Electrochemical Amination of Aryl Halides with NH3
Yaowen Liu, Yanfei Sun, Yuan Deng, Youai Qiu*
Angew. Chem. Int. Ed. 2025, DOI: 10.1002/anie.202504459
作者简介
仇友爱,南开大学化学学院特聘研究员、博士生导师、独立课题组组长(PI),南开大学“百名青年学科带头人”,入选国家高层次人才青年项目和天津市杰青项目。2015年6月博士毕业于浙江大学化学系,师从于麻生明教授。2015年9月加入瑞典斯德哥尔摩大学Jan-Erling Bäckvall教授课题组从事博士后研究。2017年9月加入德国哥廷根大学Lutz Ackermann教授课题组从事博士后研究。2019年11月起,获日本学术振兴会特别研究员奖学金(JSPS Fellowship),作为访问研究员加入日本理化学研究所(RIKEN)侯召民主任研究员课题组。2020年9月底入职南开大学化学学院元素有机化学国家重点实验室开始独立研究工作,研究集中在有机电合成化学及资源小分子高效利用等领域,以通讯作者及第一作者发表学术论文60余篇。
仇友爱课题组热诚欢迎师资博士后、博士和硕士研究生加盟,有意者请和仇老师联系:qiuyouai@nankai.edu.cn