许多天然产物、药物、配体和功能材料的分子结构中含有吡啶环,其中相当一部分是连有手性官能团的吡啶环(图1a)。化学家一般通过环上非手性官能团(卤素、烯烃等)的不对称转化(与手性试剂反应或者不对称催化转化)构筑手性官能团。与之相比,通过环上C-H键的不对称官能化反应,立体选择性地引入手性官能团,可以避免预官能化步骤(安装卤素、烯烃等),具有直接、高效的优势。近年来,利用光/有机小分子协同催化和过渡金属催化策略,吡啶C2和C4位C-H键的不对称官能化反应得到了一定发展;缺电子的C2和C4位易于发生去质子化、易于被亲核试剂进攻的内在活性决定了位置选择性。然而,吡啶C3位的不对称官能化反应一直缺少进展,分子间反应的例子还未见报道(图1b)。
近期,去芳构化-再芳构化策略已成为实现吡啶C3位官能化的重要途径。其中,王晓晨课题组、McNally课题组和Studer课题组在该方向上做出了系列工作(J. Am. Chem. Soc. 2022, 144, 4810−4818; J. Am. Chem. Soc. 2022, 144, 14463–14470; Science 2022, 378, 773–779; Science 2022, 378, 779–785; Angew. Chem. Int. Ed. 2023, 62, e202216894)(图1c)。近日,王晓晨课题组利用该策略成功实现了吡啶C3位的不对称烯丙基化反应(图1d)。这一成果发表在J. Am. Chem. Soc.上(https://pubs.acs.org/doi/10.1021/jacs.3c03056)。
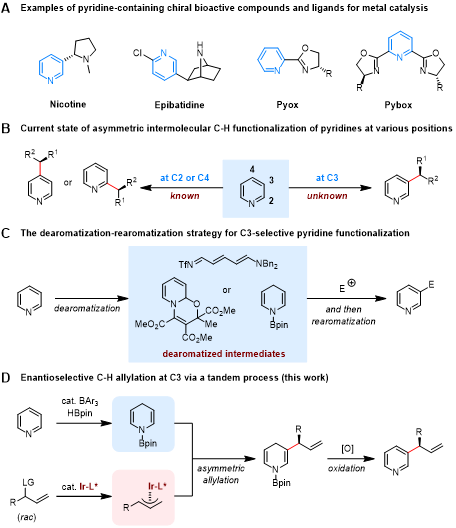
图1吡啶C3位不对称烯丙基化反应
该不对称烯丙基化反应分三步进行:第一步在BAr3 (5 mol %)催化下,吡啶 (0.20 mmol, 1.0 equiv)与频哪醇硼烷(0.30 mmol, 1.5 equiv)反应(THF,40–80 °C, 3–12 h),生成Bpin保护的二氢吡啶中间体;第二步 [Ir(cod)Cl]2 (2.5 mol %)和(R)-BHPphos (L1, 5.5 mol %)在THF中搅拌生成催化剂,再顺序加入DABCO (0.20 mmol, 1.0 equiv)、烯丙基酯(0.40–0.80 mmol, 2.0–4.0 equiv)和第一步的反应液,在30 °C下搅拌24小时,得到烯丙基取代的二氢吡啶;第三步将反应液置于空气中搅拌6小时,氧化芳构化得到最终产物。在该反应条件下,多个位置单取代和多取代吡啶以及喹啉、异喹啉、吡啶并噻吩、吡啶并呋喃和氮杂吲哚化合物都可以发生反应,且对映选择性优异。此外,作者成功将该方法应用于修饰多种含吡啶结构的药物分子和生物活性分子(图2)。
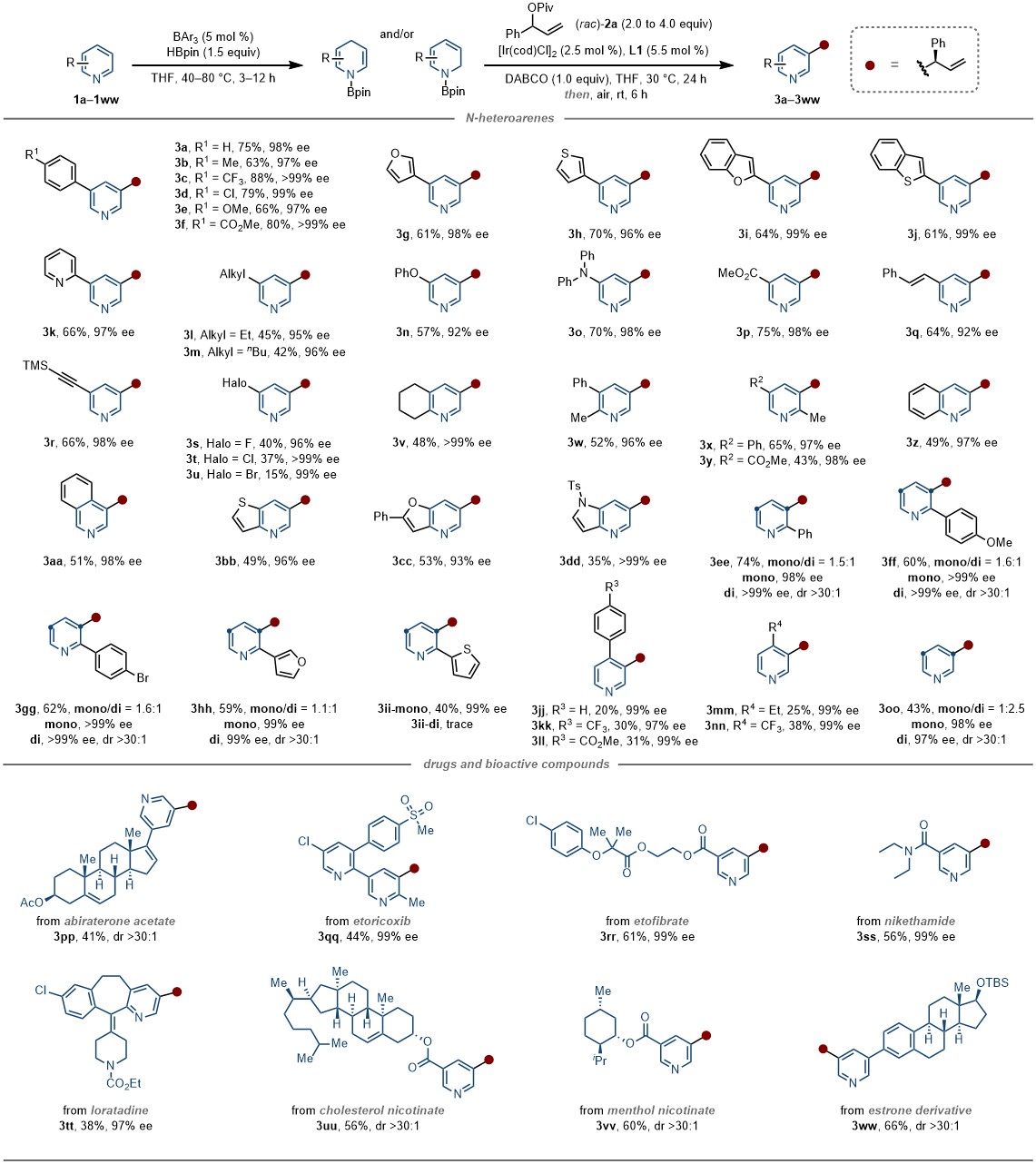
图2 氮杂芳环化合物的底物拓展
作者对烯丙基酯类底物也进行了考察。含各类取代基的苯基烯丙基酯能以较高收率及对映选择性得到目标产物;萘基、呋喃、噻吩、吡啶、吲哚、烯基和烷基取代的烯丙基酯也能够兼容(图3)。
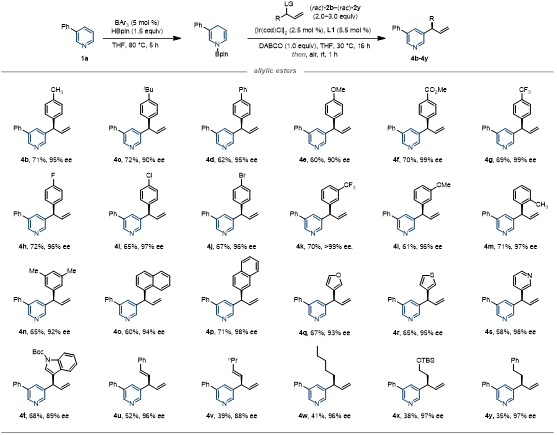
图3 烯丙基酯的底物拓展
随后,作者进行了克级实验、产物转化实验和机理验证实验,并对反应机理进行了探讨,揭示了烯丙基酯在反应中发生了动力学拆分。
综上所述,王晓晨课题组实现了吡啶的C3位不对称烯丙基化反应。该反应具有专一的位置选择性和优异的对映选择性,底物范围广,官能团兼容性好,并适用于多种药物分子和生物活性分子的后修饰。该工作是首例发生在吡啶C3位的分子间不对称C-H键官能化反应,并首次验证了有机金属亲电试剂对于去芳构化-再芳构化策略的适用性,为后续研究提供了参考。
博士后刘中和博士生石竹君为论文共同第一作者。该项研究得到了科技部、国家自然科学基金委、天津市科技局的资助。