氰基官能团广泛存在于天然产物、医药、农药和聚合物中,而且,氰基可以方便地转化为羧酸、醛、酮、酰胺和胺等官能团,所以,有机化合物的氰基化反应具有重要的应用价值。另一方面,吡啶是药物分子中最为常见的氮杂芳环,而且,很多药物存在氰基或羰基取代的吡啶,因此,发展区域选择性的吡啶C–H键氰基化方法对于药物合成和新药开发具有重要意义。利用吡啶环的缺电子性,使用氰基亲核试剂可以实现吡啶盐的邻、对位氰基化,然而,间位选择性氰基化尚无有效方法。目前,制备3-氰基吡啶主要依靠官能团转化和3-烷基吡啶的氨氧化反应。
南开大学王晓晨课题组利用吡啶硼氢化反应产生的二氢吡啶中间体,建立了吡啶间位官能化新方法,通过一锅三步反应(硼氢化、取代、氧化芳构化),先后实现了吡啶间位烷基化、三氟甲硫基化和二氟甲硫基化(J. Am. Chem. Soc. 2022, 144, 4810–4818; J. Am. Chem. Soc. 2022, 144, 14463–14470)。近日,该课题组通过引入氰基亲电试剂,实现了吡啶间位氰基化 (Angew. Chem. Int. Ed. 2023, 62, e202216894)。其中,二氢吡啶与氰基亲电试剂的取代反应经历了加成/消除的过程,该过程是系列研究中首次发现。
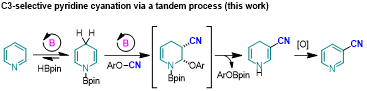
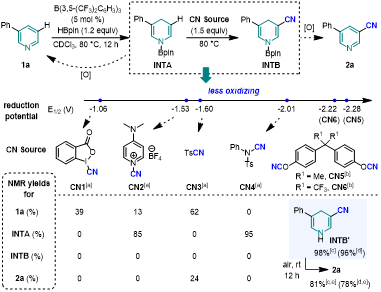
作者首先评估了硼烷催化吡啶硼氢化产生的1,4-二氢吡啶(INTA)与各种氰基亲电试剂的取代反应,发现使用氧化性较强的亲电试剂会导致1,4-二氢吡啶直接被氧化回原料,只有使用氧化性较弱且氰基转移能力较强的亲电试剂时,反应能够以较高的收率得到氰基取代的二氢吡啶,再经过氧化芳构化就可以得到3-氰基吡啶。
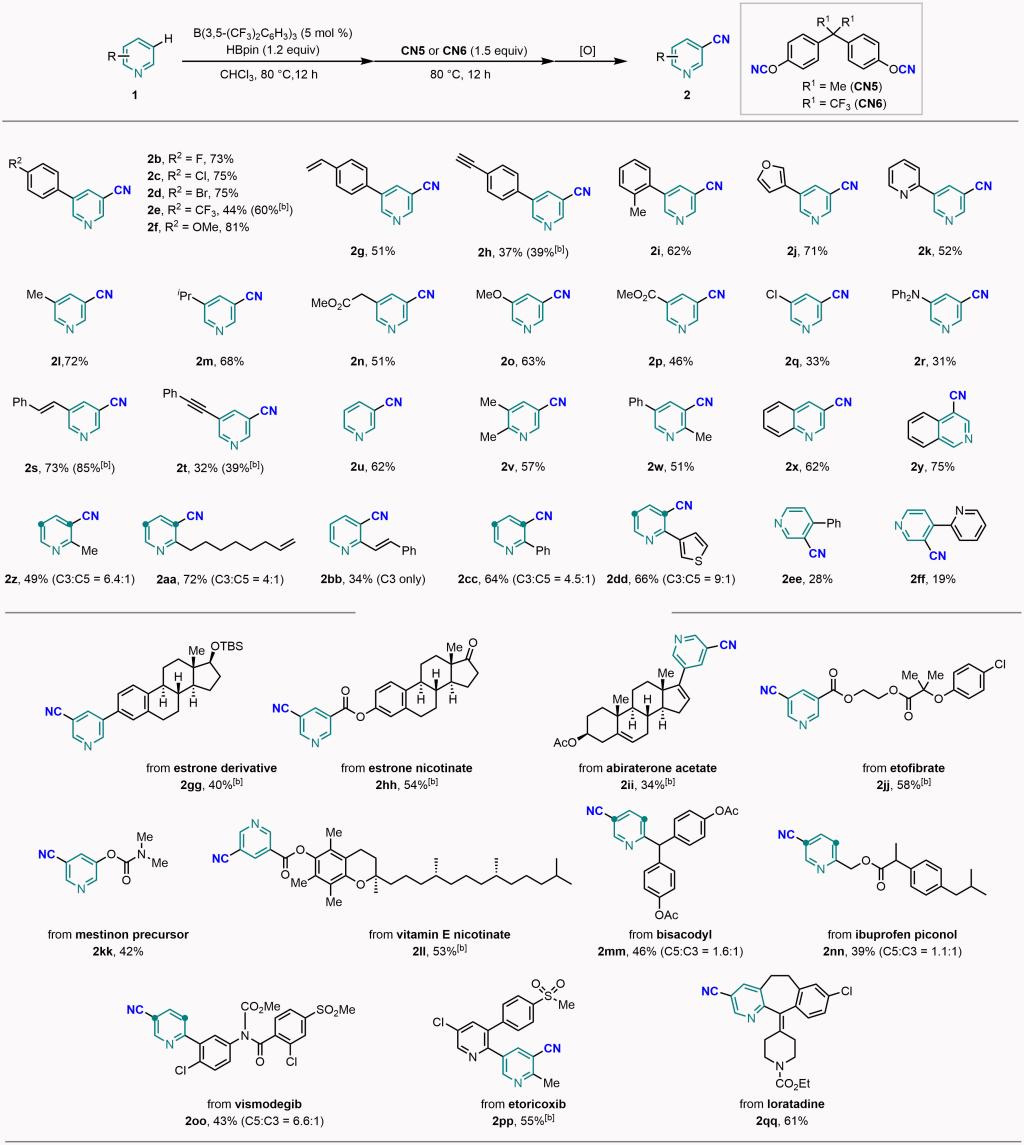
在最优条件下,作者进行了底物拓展,各种间位芳基、杂芳基、烷基取代的吡啶都能够成功地转化为相应的产物。当吡啶间位连有甲氧基、酯基、卤素、氨基、苯乙烯基、苯乙炔基等官能团时,反应同样可以进行,而且,这些官能团不会被破坏。反应对吡啶、二取代吡啶、喹啉、异喹啉也适用。邻位取代吡啶主要得到C3单氰基化产物。反应对于对位芳基取代的吡啶也能够兼容,但是收率较低。更为重要的是,该方法被成功应用于多个吡啶药物分子和衍生物的后期氰基化修饰。作者通过控制实验和理论计算对反应机理和选择性进行了深入探究。
综上所述,王晓晨课题组报道了首例间位选择性的吡啶C-H键氰基化方法。该方法具有广泛的官能团兼容性,可用于药物分子后修饰。该工作揭示了反应中亲电试剂作为氧化剂或官能团转移试剂的相互竞争过程,对于后续研究具有指导作用。
南开大学博士研究生张鸣为论文第一作者。相关研究得到了科技部重点研发计划、国家自然科学基金委、天津市科技局和南开大学的资助。
论文链接:https://onlinelibrary.wiley.com/doi/10.1002/anie.202216894