α,β-不饱和羰基化合物的不对称Vinylogous Mannich反应(简称“AVMRs”)可以高效地合成光学纯的氨基化衍生物。然而,由于该类底物的γ位酸性较弱,去质子化较为困难,导致AVMRs研究主要使用“间接法”(图A),即不饱和羰基化合物在强碱性条件下与硅试剂反应(如TMSCl或TMSOTf),先生成共轭烯醇硅醚,再与亚胺反应。然而,该方法需要制备和分离共轭烯醇硅醚,原子利用率较低,而且制备共轭烯醇硅醚的反应通常会生成不可分离的E、Z混合物,为Mannich反应选择性带来挑战。与之相比,不饱和羰基化合物在碱作用下去质子化,原位生成共轭烯醇,并直接与亚胺反应,即“直接法”AVMRs,具有原子经济高、操作简便等优点。然而,迄今为止,“直接法”AVMRs研究的底物大多局限在环状化合物(图B),如α,β-不饱和γ-丁烯内酯、γ-丁内酰胺和环状的α,α-二氰基烯烃等。因为这类环状底物的γ位质子酸性较强,而且其刚性环状骨架对于控制区域(在α或γ碳上反应)和立体选择性至关重要。相较之下,发展非环状α,β-不饱和羰基化合物的“直接法”AVMRs极具挑战。中科院上海有机化学研究所的殷亮教授使用含辅助基团的非环状不饱和酰胺底物和金属路易斯酸催化剂,实现了高选择性“直接法”AVMRs(JACS 2017, 139, 2196; JACS 2018, 140, 15170),是该研究方向的重要进展。
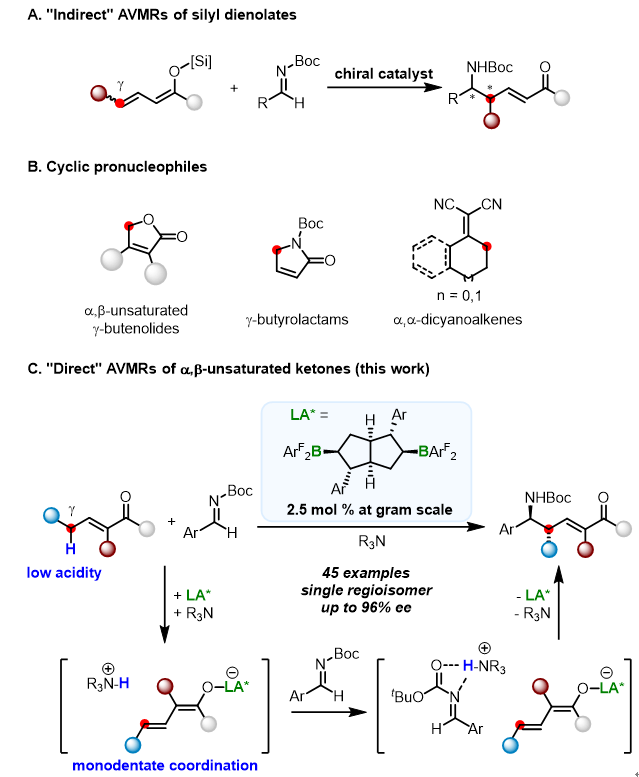
南开大学王晓晨课题组一直专注于有机硼催化研究,其发展的手性并环和螺环双硼催化剂已成功应用于一系列不对称还原反应。近期,他们使用手性并环双硼催化剂,以极高的区域选择性、非对映和对映选择性实现了非环状α,β-不饱和酮的“直接法”AVMRs,高效合成光学活性的δ-氨基-α,β-不饱和羰基衍生物。在反应过程中,硼催化剂作为强路易斯酸与羰基配位,进而增强底物γ位酸性,在有机胺的协同作用下,去质子生成手性硼连接的共轭烯醇中间体和铵根正离子;随后,共轭烯醇中间体进攻亚胺生成目标产物。其中,亚胺被铵根正离子活化,手性硼催化剂控制区域和立体选择性。
该反应不需要借助辅助基团,是首例以非环状α,β-不饱和酮为底物的“直接法”AVMRs。更为重要的是,该工作证明了手性硼催化剂的独特优势,其强路易斯酸性可以有效活化单齿、弱配位的酮类底物,其大位阻为远程手性控制提供了可能。该工作为后续手性硼不对称催化研究提供了重要参考。
相关研究论文发表于J. Am. Chem. Soc.,博士生田俊杰和刘宁为论文共同第一作者。相关研究得到了国家自然科学基金和天津市自然科学基金的资助。
文章链接:https://pubs.acs.org/doi/abs/10.1021/jacs.1c00006