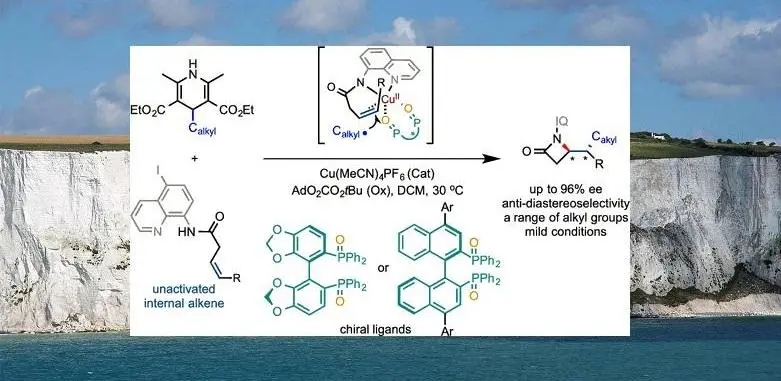
近年来,Engle课题组开发了双齿氨基喹啉(AQ或Q)导向基辅助的Pd催化的非活化烯烃与多种偶联试剂的官能化反应。此类反应通常涉及AQ辅助的亲核试剂对烯烃的亲核钯化过程,形成动力学上有利的五元/六元环钯中间体,然后将其质子化或与合适的亲电试剂反应得到单官能或双官能化产物。随后,陈弓、何刚和Engle课题组发现在单齿恶唑啉配体作用下,一些非活化烯烃的碳官能化反应能以对映选择性的方式进行。然而,该策略实现的不对称碳官能化反应主要局限于与π型亲核试剂的加成反应,例如吲哚或烯醇化合物(Scheme 1A)。最近,铜催化的自由基反应已经成为非活化端烯不对称双官能团化的一种新的途径。然而,这类反应常常需要使用缺电子的烷基自由基前体(例如·CF3)首先对端烯非立体选择性的加成启动,得到苄基自由基,然后在金属与配体作用下被导向基团立体选择性捕获得到手性产物(Scheme 1A)。普通的烷基自由基由于具有一定的亲核性,与富电子的非活化内烯烃电性不匹配,在该策略下很难实现相应的转化。因此,截至目前,普通烷基自由基对非活化烯烃的不对称加成反应仍然具有很大的挑战性。
近日,南开大学陈弓教授、何刚研究员和王浩博士团队报道了首例铜催化的非活化烯烃与普通烷基自由基的不对称双官能化反应。该反应利用一价铜作为催化剂、5-碘-8-氨基喹啉(IQ)作为导向基团、4-烷基Hantzsch酯作为烷基供体,联芳基二氧化膦配体作为手性配体,实现了非活化烯烃的不对称烷胺化反应,高效地构筑了一系列含有连续两个碳手性中心的β-内酰胺类化合物(Scheme 1B)。相关研究成果发表在J. Am. Chem. Soc.上(DOI: 10.1021/jacs.0c12333)。论文第一作者为南开大学博士研究生白子渤。
(图片来源:J. Am. Chem. Soc.)
最近,AQ导向的反应策略也拓展至不同金属催化的非活化烯烃的反式加成反应中。苏州大学赵应声课题组最近报道了铜催化的烯烃与苄基自由基的碳胺化反应,以制备β-内酰胺类衍生物(Chem. Commun. 2019, 55, 10523)。该反应以甲基芳烃作为溶剂,且需要加热至130 °C,这导致条件相对苛刻。作者设想能否在温和条件下,实现该反应的不对称转化。于是,作者以N-AQ-顺式-3-己烯酰胺1’与Hantzsch酯2为模型底物对反应进行研究(Table 1)。以Cu(MeCN)4PF6作催化剂,O1作氧化剂,L1作手性配体,底物在DCE中于50 °C下反应,以12%的收率和71:29的er值得到目标产物3(entry 1)。通过对配体筛选发现,BINAPO L5可以显著提高反应活性和对映选择性(52%的收率,82:18 的er值,entry 2)。接着作者考察了氧化剂和导向基的影响。氧化剂O4(受刘心元团队工作的启发:Angew. Chem. Int. Ed. 2020, 59, 1129)和喹啉C8处引入碘的辅助剂IQ可以进一步提升收率(entries 4-9)。最后,作者筛选了溶剂和配体,最终确定以DCM为溶剂,使用SEGPHOS的氧化物L7为配体,反应能以72%的收率和97:3的er值获得产物3(entries 18-23)。

(图片来源:J. Am. Chem. Soc.)
在最优的反应条件下,作者研究底物的适用范围。苯环上连有多种取代基的苄基-Hantzsch酯都可以顺利反应,以良好到优异的收率、单一的非对映选择性和较高的对映选择性得到β-内酰胺产物8−13(Scheme 2A)。此外,带有不同末端R基团的顺式-3-烯酰胺与苄基-DHPs反应,也能以较高收率和优异的er值得到相应的β-内酰胺类化合物14−22(Scheme 2B)。
(图片来源:J. Am. Chem. Soc.)
如Scheme 3所示,除了一系列4-苄基Hantzsch酯,在相同条件下,普通烷基自由基也能以优秀的立体选择性(98:2 er) 得到β-内酰胺化合物23,但收率稍差(伴随大量N-烷基副产物)。通过对配体的再次考察,作者发现当BINAPO配体的4, 4’位为3, 5-二甲氧基苯基时(L11, Condition D),可以有效抑制副反应,最终以72% yield, 95:5 er得到23。总的来说,在Condition D下,二级和三级烷基自由基均能兼容(24,25)。一级烷基自由基(如乙基)在该体系中还无法取得理想的结果(27)。此外,端烯与普通烷基自由基也能以优秀的收率和立体选择性得到目标产物(28)。
(图片来源:J. Am. Chem. Soc.)
基于以上实验结果和已发表的研究,作者提出了一个自由基介导的机制(Scheme 5)。首先,CuI催化剂与O4进行单电子转移(SET)氧化生成叔丁氧基自由基和CuII,其与烯烃底物I和配体L*形成络合物II。叔丁氧基自由基与R-DHP反应生成亲核烷基自由基R·、吡啶V和叔丁氧基阴离子。AQ螯合的CuII/烯烃络合物在γ位与R·自由基发生亲核(Wacker型)加成反应,形成五元CuIII金属环III,这是是决定反应对映选择性的关键步骤。III经分子内还原消除(RE)反非对映选择性地生成β-内酰胺产物P-anti,同时CuI再生。R·自由基还可以与CuII加成形成烷基-CuIII中间体VI,它通过RE得到N-烷基化副产物VII。此外,作者还通过DFT计算进一步验证了以上机理(Scheme 5B)。
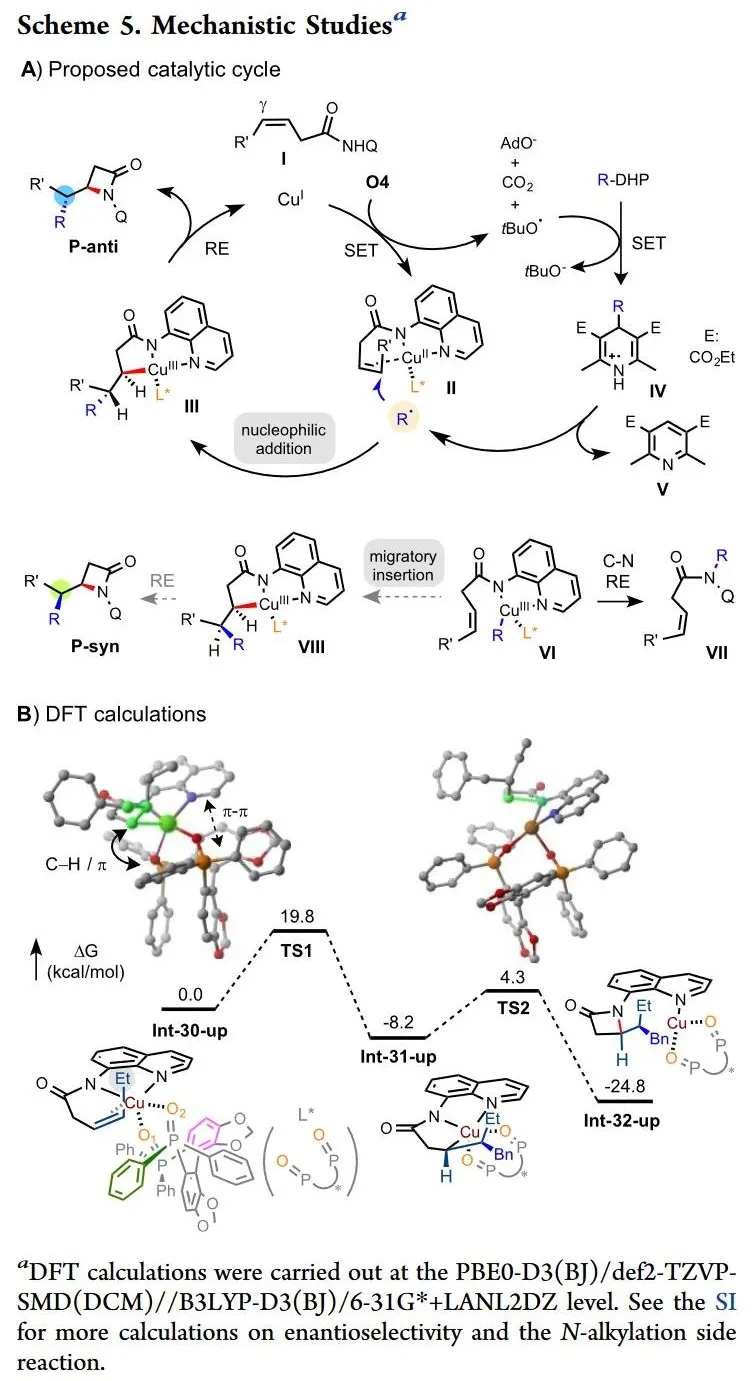
(图片来源:J. Am. Chem. Soc.)
总结:陈弓、何刚团队使用一价铜作为催化剂、氨基喹啉(IQ)作为导向基团,与BINAPO类膦氧配体结合,实现了极具挑战性的非活化内烯烃的不对称烷胺反应。该策略可以应用于其他方法难以实现的复杂手性β-内酰胺化合物的合成。与之前报道的铜催化自由基对端烯加成反应不同的是,铜在烷基自由基对内烯烃加成时就起到了对映选择性调控作用,从而在双键的两端同时引入手性,实现连续碳手性中心的构筑。该反应为非活化烯烃的不对称烷基化反应提供了新的策略,并拓展了手性膦氧配体在不对称反应中的应用范围。
原文(扫描或长按二维码,识别后直达原文页面):
