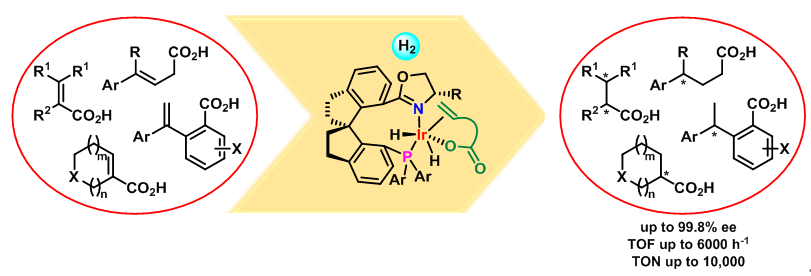
手性羧酸是重要的有机合成中间体,在合成中有广泛应用。有些手性药物,例如萘普生这种临床上普遍使用的非甾体消炎镇痛药物本身就是手性羧酸。不饱和羧酸的不对称催化氢化是合成手性羧酸最高效的方法之一。虽然人们已经发展了很多基于金属钌和铑的手性络合物催化剂,实现了不饱和羧酸的不对称氢化,但是这些手性催化剂通常存在反应压力高、活性差、底物适用范围窄等问题,阻碍了其实际应用。本实验室周其林团队经过近10年的深入研究,发展了手性螺环膦氮配体和铱的络合物催化剂,实现了多种不饱和羧酸的高效不对称氢化。最近该团队受邀在Acc. Chem. Res.(2017, 50, 988‒1001)上对这一研究成果进行了系统介绍。
该团队发现,手性螺环膦氮配体和铱的络合物可高效催化α,β-不饱和羧酸的不对称氢化。反应的工作压力低(通常为0.6 MPa,即使在常压下也能完成不对称催化氢化),底物适用范围很广,官能团的耐受性好,效率高(转化频率可达6000次/小时,转化数可达10000),对映选择性优异(最高达99.8% ee)。手性螺环膦氮配体和铱的络合物是α,β-不饱和羧酸不对称氢化反应目前最有效的催化剂之一,具有很好的工业应用前景(图1)。该团队还以该反应为关键步骤,合成了非甾体消炎药异布洛芬(ibuprofen)、萘普生(naproxen),抗癫痫手性药物盐酸噻加宾(tiagabine),以及雌马酚(equol)等天然产物和手性药物。
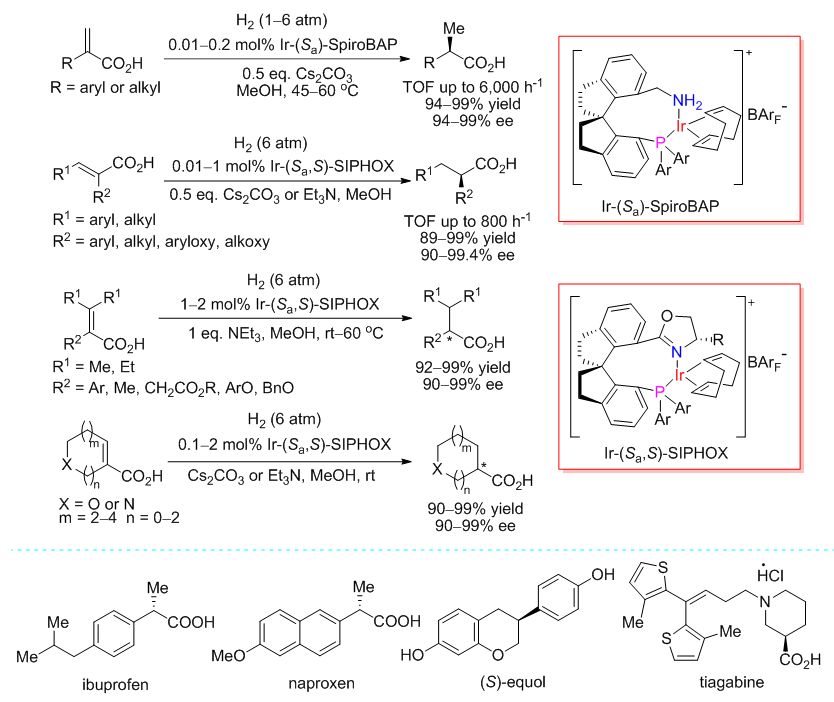
图1 手性螺环铱络合物催化α,β-不饱和羧酸的不对称氢化
在研究α,β-不饱和羧酸的不对称催化氢化反应中,该团队发现羧基在氢化反应中具有“导向”作用,并据此设计了羧基导向的烯烃不对称催化氢化策略,分别实现了β,γ-不饱和羧酸、γ,δ-不饱和羧酸、含羧酸官能团的1-取代苯乙烯的不对称催化氢化(图2)。研究表明,手性螺环铱催化剂通过和羧基的配位作用,实现了远程手性控制,进而以很高的对映选择性实现了上述这些氢化反应。以羧基导向的不饱和羧酸不对称催化氢化为关键步,该团队还完成了(R)-aristelegone-A,(R)-curcumene,(R)-xanthorrhizol,(S)-curcudiol等天然产物的高效不对称全合成。
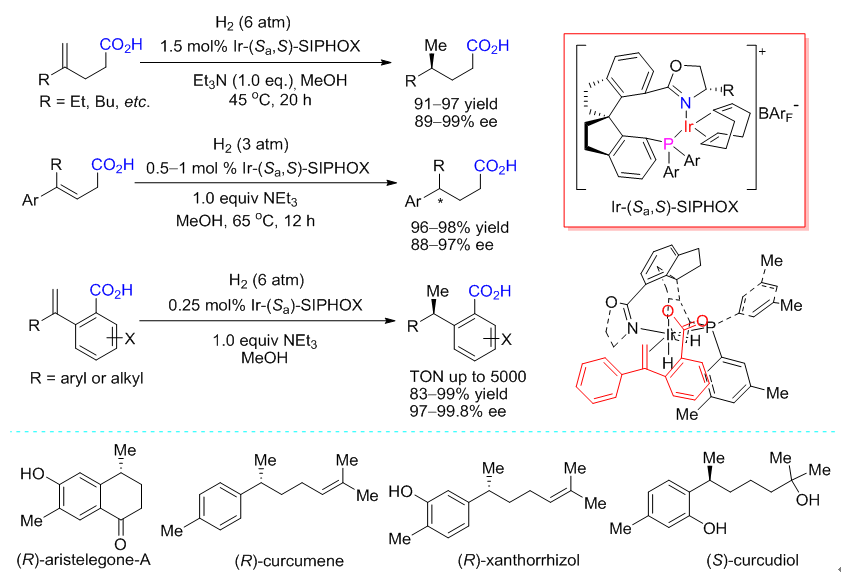
图2 手性螺环铱络合物催化羧基导向烯烃的不对称氢化
得益于上述手性铱络合物中螺环骨架的较强刚性能够有效稳定活性中间体,该团队在氢化反应条件下成功分离并表征了多种活性Ir-H中间体,并对其反应性进行了系统研究,结合计算化学,清晰阐释了该类氢化反应经历了IrIII/IrV催化循环,并发现烯烃对Ir-H键的迁移插入是反应的立体化学决定步骤,而还原消除是反应的决速步(图3)。
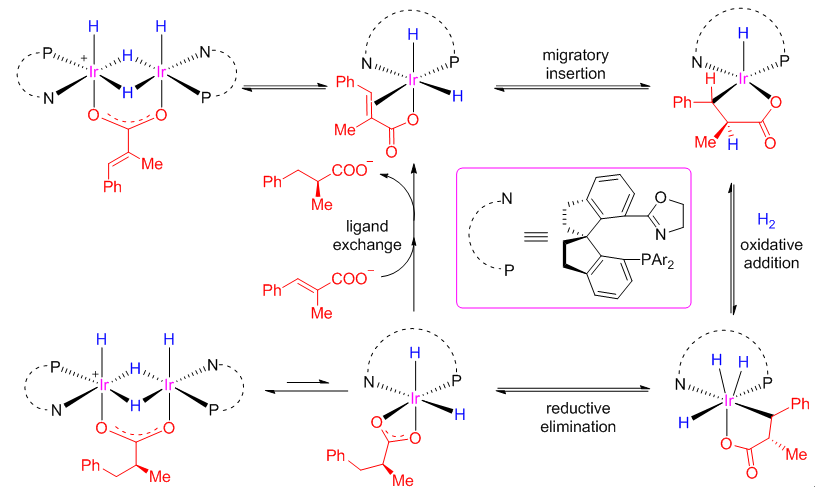
图3 手性螺环铱络合物催化不饱和羧酸的不对称氢化机理
论文信息:
Shou-Fei Zhu*, Qi-Lin Zhou*, Iridium-catalyzed asymmetric hydrogenation of unsaturated carboxylic acids, Acc. Chem. Res. 2017, 50, 988‒1001.
http://pubs.acs.org/doi/abs/10.1021/acs.accounts.7b00007